
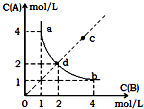
 T°C时,在一固定容积的密闭容器中发生反应:A(g)+B(g)?X(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,则判断正确的是( )
T°C时,在一固定容积的密闭容器中发生反应:A(g)+B(g)?X(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,则判断正确的是( )| A. | T℃时,该反应的平衡常数值为4 | |
| B. | c点没有达到平衡,此时反应向逆向进行 | |
| C. | 若c点为平衡点,则此时容器内的温度高于T℃ | |
| D. | T℃时,在d点加入一定量X可达到c点 |
分析 A、平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,固体和纯液体不写入表达式;
B、C点浓度商小于K,反应正向进行;
C、反应是放热反应,若C点为平衡状态,此时平衡常数小于T°C平衡常数,说明平衡逆向进行;
D、X为固体,加入一定量X平衡不移动.
解答 解:A、平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,固体和纯液体不写入表达式,A(g)+B(g)?C(s),平衡常数K=$\frac{1}{c(A)c(B)}$=$\frac{1}{4}$=0.25,故A错误;
B、依据图象分析可知,C点浓度商Q<K,反应正向进行,故B错误;
C、反应是放热反应,若C点为平衡状态,此时平衡常数小于T°C平衡常数,说明平衡逆向进行,是升温的结果,温度高于T°C,故C正确;
D、X为固体,加入一定量X平衡不移动,所以在d点加入一定量X不可达到c点,故D错误;
故选C.
点评 本题考查了化学平衡常数的影响因素分析和计算应用,主要是平衡原理的影响因素分析判断,掌握基础是关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
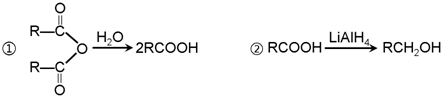
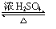 C2H5OOCCH2CH2COOC2H5+2H2O.
C2H5OOCCH2CH2COOC2H5+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
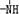 、
、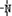 一定条件下都可以和H+结合.则N4和足量的H+反应生成的粒子的化学式为N4H44+.化学家发现一种化学式为N4H4的离子化合物,一定条件下1mol N4H4熔融电离生成两种离子,其中一种为NH4+,则该物质熔融时的电离方程式为N4H4=NH4++N3-.
一定条件下都可以和H+结合.则N4和足量的H+反应生成的粒子的化学式为N4H44+.化学家发现一种化学式为N4H4的离子化合物,一定条件下1mol N4H4熔融电离生成两种离子,其中一种为NH4+,则该物质熔融时的电离方程式为N4H4=NH4++N3-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
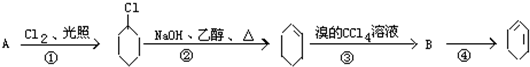
 ,名称是环己烷.
,名称是环己烷. +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaBr+2H2O.
+2NaBr+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
族 周期 | ||||||||
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸与碱发生中和反应所放出的热量称为中和热 | |
| B. | 若某反应的反应物的总能量大于生成物的总能量,则该反应为吸热反应 | |
| C. | H2→H+H的变化需要吸收能量 | |
| D. | 凡经加热而发生的化学反应都是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它可由PH3和HI化合而成 | |
| B. | 加热时PH4I可以分解,而且有颜色变化 | |
| C. | 它可以跟NaOH反应 | |
| D. | 它是一种共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com