
| A、加热看是否有气体生成 |
| B、滴入盐酸后看是否有气体生成 |
| C、溶解后检查溶液的酸碱性 |
| D、灼烧看火焰是否为黄色 |


科目:高中化学 来源: 题型:
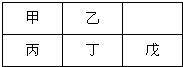 短周期金属元素甲-戊在元素周期表中的相对位置如图,下列判断正确的是( )
短周期金属元素甲-戊在元素周期表中的相对位置如图,下列判断正确的是( )| A、原子半径:丙<丁<戊 |
| B、戊只与强碱反应 |
| C、最高价氧化物对应水化物碱性:乙>丁>戊 |
| D、金属性:丙>甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 地球上的元素大多数是金属,Na、Mg、Al是常见的主族金属元素,Fe和Cu是常见的过渡金属元素.它们在化学中占有极其重要的地位.
地球上的元素大多数是金属,Na、Mg、Al是常见的主族金属元素,Fe和Cu是常见的过渡金属元素.它们在化学中占有极其重要的地位.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、与足量水反应并加热,收集到标准状况下V1L干燥气体 |
| B、与足量稀盐酸反应并蒸干,称量剩余固体质量m1g |
| C、隔绝空气加热,冷却后,称量剩余固体质量m2g |
| D、溶于足量水,滴入足量氯化钙溶液,过滤、洗涤、干燥、称重质量为m3g |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 充电 |
| 放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ |
| B、钠和水反应:2Na+2H2O=2Na++2OH-+H2↑ |
| C、向NaHCO3溶液中滴入少量稀硫酸:2H++CO32-=CO2↑+H2O |
| D、盐酸中加入氢氧化镁:H++OH-=H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、制取氢气 |
| B、粗盐提纯 |
| C、分离苯和水的混合物 |
| D、用氯化钠晶体配制100g 5%的氯化钠溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com