
【题目】填写下列空格。
(1)已知拆开1molH-H键、1molCl-Cl键、1molH-Cl键分别需要吸收的能量为436.4kJ、242.7kJ、431.8kJ。则由H2和Cl2反应生成1molHCl需要_____(填“放出”或“吸收”)____kJ的热量。
(2)H2可以在Cl2中安静地燃烧。甲、乙两图中,能表示该反应能量变化的是图_____(填“甲”或“乙”)。

(3)已知:H2与Cl2在光照条件下会发生爆炸。同温同压下,反应H2(g)+Cl2(g)=2HCl(g)。在光照和点燃条件下的H_____(填“相等”或“不相等”)。
(4)硅、磷、硫、氯元素的气态氢化物的形成条件和热稳定性如下表所示:
元素符号 | Si | P | S | Cl |
单质与氢气的反应 | 高温下反应 | 磷蒸气与氢气能反应 | 加热时反应 | 光照或点燃时发生爆炸而化合 |
气态氢化物的热稳定性 | 不稳定 | 不稳定 | 受热分解 | 稳定 |
结合元素原子结构等知识,分析以上信息可得出的结论是:同周期非金属元素,随着元素核电荷数的递增,____________________________________,因此,Si、P、S、Cl非金属性依次增强。
【答案】 放出 92.25 甲 相等 原子半径逐渐减小,元素原子得电子能力逐渐增强
【解析】根据反应吸放热的条件进行判定。断键消耗的能量大于成键释放的能量为吸热反应,反之为放热反应。反应热H只与反应物和生成物的状态有关,与途径无关。根据元素周期律知识,同周期元素的非金属性随着原子序数增大而增强, 原子半径依次减小,核对外层电子的引力逐渐增大, 得电子能力逐渐增强的知识解答相关问题。
(1)在H2(g)+Cl2(g)=2HCl(g)反应中断裂1molH-H键、1molCl-Cl键共吸收的能量=436.4kJ+ 242.7kJ=679.1 kJ,生成2molHCl(g) 释放的能量=431.8kJ![]() 2 =863.5 kJ吸收的能量=679.1 kJ <释放出的能量863.5 kJ故该反应为放热反应,需要释放能量, 生成1molHCl释放的能量为:(863.5 kJ-679.1 kJ)/2=92.2 kJ
2 =863.5 kJ吸收的能量=679.1 kJ <释放出的能量863.5 kJ故该反应为放热反应,需要释放能量, 生成1molHCl释放的能量为:(863.5 kJ-679.1 kJ)/2=92.2 kJ
(2)H2在Cl2中燃烧属于放热反应,反应物的总能量大于生成物的总能量,根据图像分析知甲是放热反应,乙是吸热反应,所以能表示H2在Cl2中燃烧反应能量变化的是甲。答案:甲。
(3)反应热H只与反应物和生成物的状态有关,与途径无关,H2与Cl2在光照条件和点燃条件下的反应都是H2(g)+Cl2(g)=2HCl(g)。所以在光照和点燃条件下H相等。答案:相等。
(4) Si、P、S、Cl四种元素原子的电子层数相同,属于同一周期元素,根据实验他们与H2反应的条件的难易程度知非金属性逐渐增强,原因是根据元素周期律知识,同周期元素的非金属性随着原子序数增大而增强, 原子半径依次减小,核对外层电子的引力逐渐增大, 得电子能力逐渐增强。答案:原子半径逐渐减小,元素原子得电子能力逐渐增强。


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,水溶液中H+和OH﹣的浓度变化曲线如图,下列说法正确的是( ) 
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10﹣13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为长式周期表的一部分,其中的编号代表对应的元素. 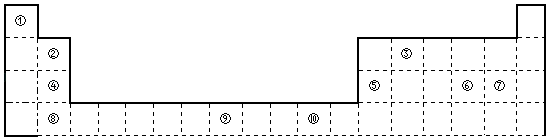
请回答下列问题:
(1)③和①形成的一种5核10电子分子,其立体构型为 , 中心原子杂化方式为 , 属于分子(填“极性”或“非极性”).
(2)元素③和⑦的最高价氧化物对应水化物中酸性较强的是:(填化学式)元素⑥的电负性元素⑦(选填“>”、“=”、“<”=)的电负性.
(3)根据元素周期表分区,元素⑨位于区,其基态原子电子排布式为 .
(4)某些不同族元素的性质也有一定的相似性,如上表中元素②与元素⑤的氢氧化物有相似的性质.请写出元素②的氢氧化物与NaOH溶液反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在溶液中可以大量共存,加OH-产生沉淀,加H+生成气体的一组离子是( )
A.Na+、Cu2+、CO32-、Cl-
B.Na+、 Cl-、 HCO3-、Mg2+
C.Cl-、NO3-、K+、 Ca2+
D.NH4+、 K+、 H+、 SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,向20mL0.01mol/LCH3COOH溶液中逐滴加入0.01mol/LKOH溶液,其pH变化曲线如图所示。下列叙述错误的是

A. a>2
B. 醋酸的电离平衡常数:Ka= ![]()
C. b点溶液中:c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)
D. a、b、c、d四点溶液的导电性强弱顺序:d>c>b>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+B―→C分两步进行:①A+B―→X,②X―→C,反应过程中能量变化如图所示,E1表示反应A+B―→X的活化能。下列有关叙述正确的是( )
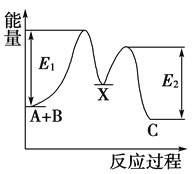
A. E2表示反应X―→C的活化能
B. X是反应A+B―→C的催化剂
C. 反应A+B―→C的ΔH<0
D. 加入催化剂可改变反应A+B―→C的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据问题填空:
(1)氟化氢水溶液中存在的氢键有种;分子(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子最外层均满足8电子稳定结构,其结构式为 , 1个分子中含有个π键;
(2)金属镍及其化合物在合金材料以及催化剂等方面应用广泛,NiO的晶体结构类型与氯化钠的相同,NiO晶胞中Ni和O的配位数均为;很多不饱和有机物在Ni催化下可以H2发生加成反应,如①CH2=CH2、②HC≡CH、③ ![]() 、④HCHO等,其中碳原子不是采取sp2杂化的分子有(填物质编号),HCHO分子的立体构型为 .
、④HCHO等,其中碳原子不是采取sp2杂化的分子有(填物质编号),HCHO分子的立体构型为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用溴和苯反应制取溴苯,得到粗溴苯后,要用如下操作精制:
①蒸馏;②水洗;③用干燥剂干燥;④10%NaOH溶液洗;⑤水洗。
正确的操作顺序是
A. ①②③④⑤ B. ④②③①⑤ C. ②④①⑤③ D. ②④⑤③①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com