
下列电离方程式正确的是( )
|
| A. | NH3•H2O═NH4﹣+OH﹣ | B. | NaHCO3═Na++H++CO32﹣ |
|
| C. | CH3COONa═CH3COO﹣+Na+ | D. | H2S⇌2H++S2﹣ |
| 电离方程式的书写. | |
| 专题: | 电离平衡与溶液的pH专题. |
| 分析: | 先判断弱电解质还是弱电解质,强电解质在溶液中完全电离,用等号,弱电解质部分电离,用可逆号,多元弱酸的电离分步进行,主要以第一步为主,电离方程式只写出第一步即可,据此进行解答. |
| 解答: | 解:A.一水合氨为弱电解质,溶液中部分电离,用可逆号,正确的电离方程式为:NH3•H2O⇌NH4﹣+OH﹣,故A错误; B.碳酸氢钠为强电解质,在溶液中完全电离出钠离子和碳酸氢根离子,正确的电离方程式为:NaHCO3═Na++HCO3﹣,故B错误; C.醋酸钠为强电解质,溶液中完全电离,其电离方程式为:CH3COONa═CH3COO﹣+Na+,故C正确; D.氢硫酸为二元弱酸,其电离过程分步进行,主要以第一步为主,氢硫酸正确的电离方程式为:H2S⇌H++HS﹣,故D错误; 故选C. |
| 点评: | 本题考查了电离方程式的书写判断,题目难度不大,注意掌握强弱电解质的概念及判断方法,明确电离方程式的书写原则. |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列说法正确的是()
A. 任何状态下,1molCO2和18克水所含的分子数和原子数都相等
B. 22.4L的任何气体的物质的量为1mol
C. 非标准状况下,1mol任何气体的体积必定不是22.4L
D. 标准状况下,1molSO3的体积是22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式的是( )
A.硫酸铝溶液中加入过量氨水
Al3++3OH-====Al(OH)3↓
B.碳酸钠溶液中加入澄清石灰水
Ca(OH)2+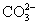 ====CaCO3↓+2OH-
====CaCO3↓+2OH-
C.冷的氢氧化钠溶液中通入氯气
Cl2+2OH-====ClO-+Cl-+H2O
D.稀硫酸中加入铁粉
2Fe+6H+====2Fe3++3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
某离子晶体晶胞结构如图(●)X位于立方体的顶点,(○)Y位于立方体的中心。

(1)晶体中每个Y同时吸引着________个X,每个X同时吸引着________个Y,该晶体的化学式为________。
(2)晶体中在每个X周围与它最接近且距离相等的X共有________个。
(3)晶体中距离最近的2个X与一个Y形成的夹角∠XYX为________(填角的度数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
在K2Cr2O7溶液中存在如下平衡:Cr2O72﹣+H2O⇌2CrO42﹣+2H+.向橙色的K2Cr2O7溶液中加入X溶液,可使溶液变黄,下列说法一定不正确的是( )
|
| A. | 加入X溶液,上述平衡正向移动 |
|
| B. | Cr2O72﹣的物质的量浓度增大 |
|
| C. | X溶液可能是NaOH溶液 |
|
| D. | 再加入H2SO4,可使黄色溶液变为橙色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
为了说明影响化学反应速率快慢的因素,甲、乙、丙、丁四位同学分别设计了如下A﹣D四个实验,你认为结论不正确的是( )
|
| A. | 将铜片放入稀硫酸中,无现象.若再向所得溶液中加入硝酸银溶液,一段时间后,由于形成原电池,可看到有氢气生成 |
|
| B. | 将表面积、质量都相同的镁条和铝条分别与同浓度的盐酸反应,前者速率大于后者 |
|
| C. | 两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同 |
|
| D. | 相同条件下等质量的块状和粉末状大理石分别与相同浓度的盐酸反应时,粉末状的反应速率快 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下面有关丙烷、丙烯、丙炔说法中正确的是
A.如图,丙烷、丙烯、丙炔的结构分别表示为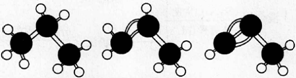
B.相同物质的量的三种物质完全燃烧,生成的气体在标准状态下,体积比3 : 2 : 1
C.丙烷、丙烯、丙炔三种物质的熔沸点逐渐升高,相同条件下密度逐渐增大
D.丙炔的碳原予空间结构呈线性排列
查看答案和解析>>
科目:高中化学 来源: 题型:
pH相同的氨水、NaOH和Ba(OH)2溶液,分别用蒸馏水稀释到原来的X、Y、Z倍,稀释后三种溶液的pH仍然相同,则X、Y、Z的关系是( )
A.X=Y=Z B.X>Y=Z
C.X<Y=Z D.X=Y<Z
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com