
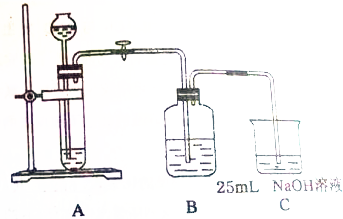
 某同学拟用50mlNaOH溶液吸收CO2气体制备Na2CO3溶液.为了防止通入的CO2气体过量生产NaHCO3,他设计了如下实验步骤:
某同学拟用50mlNaOH溶液吸收CO2气体制备Na2CO3溶液.为了防止通入的CO2气体过量生产NaHCO3,他设计了如下实验步骤:分析 氢氧化钠与而足量二氧化碳的反应:NaOH+H2O+CO2=NaHCO3,
NaHCO3与氢氧化钠反应:NaHCO3+NaOH=Na2CO3+H2O,
(1)根据碳酸氢钠与氢氧化钠反应恰好1:1反应生成碳酸钠;
(2)相同质量的石灰石和碳酸钠,碳酸钠的接触面积大,所以反应速率快,不利于二氧化碳的吸收;石灰石与盐酸为放热反应,盐酸挥发出氯化氢气体,制得的二氧化碳气体中有氯化氢,B装置选择碳酸氢钠除去氯化氢气体;
(3)如果实验步骤②③的顺序对调,溶液中溶解了部分二氧化碳,二氧化碳和氢氧化钠反应,使氢氧化钠的量减少,混合液中碳酸氢钠和氢氧化钠的物质的量不相等,所以不能恰好完全反应生成碳酸钠.
解答 解:(1)氢氧化钠和过量二氧化碳反应生成碳酸氢钠,生成的碳酸氢钠的物质的量与氢氧化钠 的物质的量相等,且碳酸氢钠与氢氧化钠反应恰好1:1反应生成碳酸钠,所以能;
故答案为:能;NaHCO3+NaOH=Na2CO3+H2O二者恰好完全反应;
(2)碳酸钠是粉末状的固体,相同质量的石灰石和碳酸钠,碳酸钠的接触面积大,所以反应速率快,不利于二氧化碳的吸收,所以不能;该反应是放热反应,随着反应的进行,溶液的温度升高,盐酸具有挥发性,所以生成的二氧化碳中含有氯化氢气体,为了除去二氧化碳中的氯化氢气体又不引进新的杂质,用饱和的碳酸氢钠溶液吸收氯化氢;
故答案为:不能;饱和的NaHCO3溶液;除去氯化氢气体;
(3)如果实验步骤②③的顺序对调,溶液中溶解了部分二氧化碳,二氧化碳和氢氧化钠反应,使氢氧化钠的量减少,混合液中碳酸氢钠和氢氧化钠的物质的量不相等,所以不能恰好完全反应生成碳酸钠,所以不对;
故答案为:不对,过量的CO2消耗NaOH,不能使NaHCO3全部转化为Na2CO3.
点评 考查学生对于实验方案的理解、实验装置的理解、试剂的选择、难度中等,(2)中试剂的选择为易错点,容易选择碳酸钠溶液,注意碳酸钠可以吸收二氧化碳和反应与物质量的关系.


科目:高中化学 来源: 题型:选择题
| A. | 铝锂合金的硬度大于纯铝、熔点低于锂单质 | |
| B. | 改变原料的配比,可以制得性能不同的铝锂合金 | |
| C. | 铝锂合金的性质与各成分金属的性质完全相同 | |
| D. | 铝锂合金优点是密度较小、强度较大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当容器内密度保持不变时,可以判断反应已达平衡 | |
| B. | 其他条件不变,将容器体积变为5L,C的平衡浓度变为原来的2倍 | |
| C. | 其他条件不变.若增大压强,则物质A的转化率减小 | |
| D. | 达到平衡时,C的体积百分含量为35.3% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
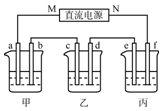 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5%的NaOH溶液、足量的CuSO4溶液和10.00%的K2SO4溶液,电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5%的NaOH溶液、足量的CuSO4溶液和10.00%的K2SO4溶液,电极均为石墨电极.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体中含有受热不分解的杂质 | |
| B. | 加热过程中有少量晶体爆溅损失 | |
| C. | 加热后未放入干燥器中冷却 | |
| D. | 加热时未进行搅拌,看到固体边缘变白就停止加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、NO3- | B. | S2-、AlO2- | C. | Al3+、Fe3+ | D. | MnO4-、NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2、NO、O2的物质的量之比是2:1:1 | |
| B. | 单位时间内生成1mol O2的同时生成2mol NO2 | |
| C. | 混合气体的颜色不再改变的状态 | |
| D. | 混合气体的平均相对分子质量不再改变的状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在熔融电解质中,O2-由负极移向正极 | |
| B. | 电池的正极通入丙烷 | |
| C. | 电路中每通过5 mol 电子,约有5.6 L标准状况下的丙烷被完全氧化 | |
| D. | 在电池正极的电极反应为O2-4e-═2O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ③④⑤⑥ | C. | ②③④⑤ | D. | 全部都可以 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com