
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
分析 ①由表中数据可知,随温度升高平衡常数减小,说明升高温度平衡逆向移动,则正反应为放热反应;
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则:
CO(g)+2H2(g)═CH3OH(g)
起始浓度(mol):1 3 0
变化浓度(mol):0.8 1.6 0.8
平衡浓度(mol):0.2 1.4 0.8
转化率=$\frac{浓度变化量}{起始浓度}$×100%,根据K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$计算平衡常数,进而判断温度.
解答 解:①由表中数据可知,随温度升高平衡常数减小,说明升高温度平衡逆向移动,则正反应为放热反应,故△H<0,故答案为:<;
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则:
CO(g)+2H2(g)═CH3OH(g)
起始浓度(mol):1 3 0
变化浓度(mol):0.8 1.6 0.8
平衡浓度(mol):0.2 1.4 0.8
CO转化率=$\frac{0.8mol}{1mol}$×100%=80%,平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$=$\frac{0.8}{0.2×1.{4}^{2}}$=2.042,故温度为250℃,
故答案为:80%;250℃.
点评 本题考查化学平衡计算、平衡常数及影响因素,注意平衡常数及单位与方程式中化学计量数有关,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | $\frac{25}{16}$ | B. | $\frac{5}{4}$ | C. | 35 | D. | 20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,1L pH=1的H2SO4溶液中,SO42-数目为0.1NA | |
| B. | 将7.8gNa2O2放入足量的CO2和水蒸气组成的气体中充分反应,转移电子总数为0.1 NA | |
| C. | 9g重氧水(H218O)含电子总数为10 NA | |
| D. | 常温常压下,2.24L正戊烷、异戊烷及新戊烷的混合物,含C-H数目为1.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滤去不溶性杂质以后,将滤液移至坩埚内加热浓缩 | |
| B. | 蒸发时,待出现大量固体时停止加热,用余热将其烘干 | |
| C. | 蒸馏时,温度计水银球应位于蒸馏烧瓶支管口处,测量蒸出气体的温度 | |
| D. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2F2+2H2O═4HF+O2 | B. | 2Na+2H2O═2NaOH+H2↑ | ||
| C. | Cl2+H2O═HCl+HClO | D. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应2Mg(s)+CO2(g)═C(s)+2MgO(s)能自发进行,则该反应的△H<0 | |
| B. | SO2的催化氧化反应是一个放热反应,所以升高温度时,正反应速率减慢 | |
| C. | 反应CaCO3(s)=CaO(s)+CO2(g)的△S<0 | |
| D. | FeCl3与KSCN反应达到平衡时,加入KCl溶液,则溶液颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
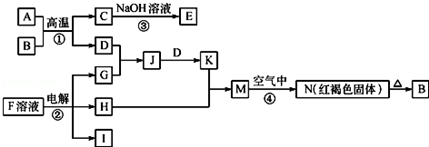
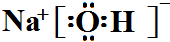 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com