实验室常见浓盐酸和二氧化锰反应来制取少量氯气,反应的化学方程式为:MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O.8.7g的MnO2与50mL足量的浓盐酸发生反应制取氯气.计算:
(1)被氧化的HCl有______mol,转移的电子数为______个.
(2)若向反应后剩余溶液中,加入足量AgNO3溶液,生成沉淀57.4g,求原浓盐酸的物质的量浓度?(要有具体的计算过程)
解:(1)设被氧化的HCl的物质的量是x,转移电子的个数是y,
则MnO
2+2HCl(浓)+2HCl(浓)(被氧化)═MnCl
2+Cl
2↑+2H
2O 转移电子
87g 2mol 2N
A
8.7g x y
x=
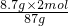
=0.2mol,y=
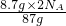
=0.2N
A
答:被氧化的HCl有 0.2mol,转移的电子数为0.2N
A个.
(2)通过(1)分析知,参加氧化还原反应的盐酸的物质的量是0.2mol,
设没参加氧化还原反应的氯离子的物质的量是z,
Cl
-+Ag
+=AgCl↓
1mol 143.5g
z 57.4g
z=
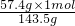
=0.4mol,
根据原子守恒知,盐酸和二氧化锰反应后的溶液中氯离子的物质的量等于未参加氧化还原反应的盐酸的物质的量,为0.4mol,所以原来溶液中盐酸的物质的量=0.2mol+0.4mol=0.6mol,
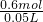
=12mol/L,
答:原来盐酸的浓度是12mol/L.
分析:(1)根据参加反应的二氧化锰和被氧化的盐酸、转移电子之间的关系式计算,注意参加反应的盐酸有一半作酸,一半作还原剂;
(2)根据二氧化锰的量计算参加氧化还原反应的盐酸的量,用生成沉淀的量计算溶液中氯离子的物质的量,再根据原子守恒计算盐酸的物质的量浓度.
点评:本题以二氧化锰和浓盐酸的反应为载体考查了氧化还原反应,注意参加反应的盐酸一半作酸一半作还原剂,为易错点.

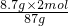 =0.2mol,y=
=0.2mol,y=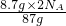 =0.2N A
=0.2N A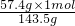 =0.4mol,
=0.4mol,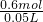 =12mol/L,
=12mol/L,

 全能测控一本好卷系列答案
全能测控一本好卷系列答案