某研究学习小组利用如图1装置进行铜与浓硫酸反应的产物及有关产物性质的探究实验.
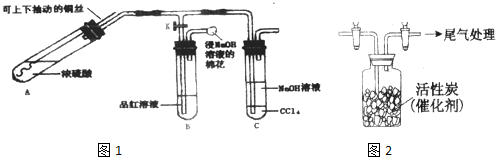
(Ⅰ)实验步骤与现象如下:
①检查装置气密性,向A中加入5mL浓硫酸.打开K,将铜丝伸入浓硫酸中,给A处加热,观察到B中品红溶液褪色,再关闭K.
②实验观察到A中液面下铜丝变黑,产生气泡,液面上方产生大量白雾,一段时间后溶液中有白色固体出现,拉出铜丝,停止加热.
回答下列问题:
(1)溶液中白色固体是
(填化学式),C中CCl
4的作用是
.
(2)取出铜丝,用蒸馏水洗净后伸入到稀硫酸中,铜丝变亮、溶液变蓝.写出A中可能发生反应的化学方程式:
、
.
(3)分离出C中的上层液体的操作名称为:
.
(Ⅱ)依据SO
2具有还原性,推测SO
2能被Cl
2氧化生成SO
2Cl
2.查阅资料:SO
2Cl
2常温下为无色液体,极易水解,遇潮湿空气会产生白雾.用如图2所示装置收集满Cl
2,再通入SO
2,集气瓶中立即产生无色液体,充分反应后,将液体和剩余气体分离,进行如下研究.
(1)研究反应的产物,向所得液体中加水,出现白雾,振荡、静置得到无色溶液,经检验该溶液中的阴离子(除OH
-外)只有SO
42、Cl
-,证明无色液体是SO
2Cl
2.
①写出SO
2Cl
2与H
2O反应的化学方式
.
②检验该溶液中Cl
-的方法是
.
(2)继续研究反应进行的程度,用NaOH溶液吸收分离出的气体,用稀盐酸酸化后,再滴加BaCl
2溶液,产生白色沉淀.
①该白色沉淀的成分是
.
②写出SO
2与Cl
2反应的化学方程式
,并阐述理由
.




