
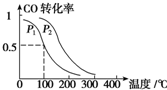
 ��ҵ��CO Ҳ���ںϳɼ״���
��ҵ��CO Ҳ���ںϳɼ״������� ����ͬ�¶��£�ͬһ�����У�����ѹǿ��ƽ��������Ӧ�����ƶ�����CO��ת��������
�ڸ��¶��£�ƽ��ʱn��CO��=amol����1-0.5��=0.5amol��n��CH3OH��=c��CO�����μӷ�Ӧ��=amol��0.5=0.5amol��n��H2��=2amol-2��amol��0.5=amol����c��CO��=$\frac{0.5a}{V}$mol/L��c��CH3OH��=$\frac{0.5a}{V}$mol/L��c��H2��=$\frac{a}{V}$mol/L����ѧƽ�ⳣ��K=$\frac{c��C{H}_{3}OH��}{c��CO����{c}^{2}��{H}_{2}��}$��
��Ӱ�췴Ӧ���ʵ��������¶ȡ�Ũ�ȡ�ѹǿ�ʹ�����Ӱ��ƽ���ƶ����������¶ȡ�Ũ�Ⱥ�ѹǿ���ݴ˷�����
��� �⣺����ͬ�¶��£�ͬһ�����У�����ѹǿ��ƽ��������Ӧ�����ƶ�����CO��ת����������ͼ��֪��p1С��p2���ʴ�Ϊ��С�ڣ�
�ڸ��¶��£�ƽ��ʱn��CO��=amol����1-0.5��=0.5amol��n��CH3OH��=c��CO�����μӷ�Ӧ��=amol��0.5=0.5amol��n��H2��=2amol-2��amol��0.5=amol����c��CO��=$\frac{0.5a}{V}$mol/L��c��CH3OH��=$\frac{0.5a}{V}$mol/L��c��H2��=$\frac{a}{V}$mol/L����ѧƽ�ⳣ��K=$\frac{c��C{H}_{3}OH��}{c��CO����{c}^{2}��{H}_{2}��}$=$��\frac{V}{a}��^{2}$���ʴ�Ϊ��=$��\frac{V}{a}��^{2}$��
��a��ʹ�ø�Ч��������Ӧ���ʼӿ죬��ƽ�ⲻ�ƶ����ʲ�ѡ��
b�����ͷ�Ӧ�¶ȣ���Ӧ���ʼ������ʲ�ѡ��
c��ͨ��H2����Ӧ���ʼӿ죬ƽ�������ƶ���CO��ת��������ѡ��
d���������������������£�������a mol CO��2a molH2���൱������ѹǿ��ƽ��������У��ﵽ��ƽ��ʱһ����̼ת��������ѡ��
e�����Ͻ�CH3OH�ӷ�Ӧ������з����������Ӧ���ʼ������ʲ�ѡ��
�ʴ�Ϊ��cd��
���� ���⿼���˻�ѧƽ�ⳣ������ʽ��д�Լ����㡢��ѧƽ��Ӱ�����ط����жϡ���ѧƽ��״̬���жϣ����ջ����ǹؼ�����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �ζ����� | ����Һ�����mL�� | �����������mL�� | |
| �ζ�ǰ������mL�� | �ζ��������mL�� | ||
| ��һ�� | 10.00 | 0.60 | 20.50 |
| �ڶ��� | 10.00 | 3.00 | 23.10 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | F-��Cl-��Br-��I-�Ļ�ԭ������ | B�� | NaOH��KOH��RbOH�ļ������� | ||
| C�� | Li��Na��K��Rb��Cs�Ľ��������� | D�� | HF��HCl��HBr��HI���ȶ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ǿ����ʵ���Һһ����������ʵ���Һ������ǿ | |
| B�� | ������ǿ����ʵ���Һ�в��������ʷ��� | |
| C�� | ǿ����ʶ������ӻ������������ʶ��ǹ��ۻ����� | |
| D�� | �������ᱵ������ˮ��������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��⾫��ͭʱ���������к���Zn��Fe��Ag��Au�Ƚ��� | |
| B�� | ����Ksp��CaCO3����Ksp��CaSO4�����������п���Na2CO3��Һ������¯ˮ���е�CaSO4��ʹ֮ת��Ϊ���ɡ����������CaCO3 | |
| C�� | �����£�������ϡ��Һ��ˮϡ�ͣ���Һ��$\frac{c��{H}^{+}��}{c��C{H}_{3}COOH��}$��С | |
| D�� | ��֪��Ӧ��3H2��g��+WO3��s��=W��s��+3H2O��g��ֻ���ڸ���ʱ�����Է����У������ġ�S��0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ˮ���γɵ�Al��OH��3����������ˮ�е������������ˮ�ľ��� | |
| B�� | �ں������������п�飬�ɼ�������ĸ�ʴ���� | |
| C�� | 2NO��g��+2CO��g��=N2��g��+2CO2��g�� �ڳ��������Է����У���÷�Ӧ�ġ�H��0 | |
| D�� | ���MgCl2������Һ�����Ƶý���þ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
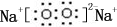 ��0.10mol�û�����������ˮ��Ӧʱת�Ƶĵ�����Ϊ6.02��1022��
��0.10mol�û�����������ˮ��Ӧʱת�Ƶĵ�����Ϊ6.02��1022���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������ˮ | B�� | �������ˮ | C�� | ������Ҵ� | D�� | ����ˮ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com