
| Al(OH)3 | Fe(OH)3 | |
| 开始沉淀时 | 3.6 | 2.1 |
| 完全沉淀时 | 5.2 | 3.2 |
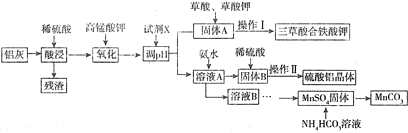
分析 铝灰(含Al、Al2O3及少量SiO2和FeO•xFe2O3),加入过量稀硫酸酸溶过滤,滤液为硫酸铝、硫酸亚铁、硫酸铁,残渣为二氧化硅和不溶性杂质,过滤后在滤液中加入稍过量高锰酸钾溶液氧化亚铁离子为铁离子,用氧化铝或氢氧化铝调节溶液PH使铁离子全部沉淀,铝离子不沉淀,得固体A为氢氧化铁,溶液A中含有铝离子,溶液A中加入氨水后得固体B为氢氧化铝,固体B中加入稀硫酸得硫酸铝溶液,再将硫酸铝溶液蒸发浓缩、降温结晶过滤洗涤得到硫酸铝钾晶体,溶液B中含有锰离子和硫酸根离子,硫酸锰固体溶于碳酸氢铵溶液可得碳酸锰沉淀,根据元素守恒可书写化学方程式,据此答题.
解答 解:铝灰(含Al、Al2O3及少量SiO2和FeO•xFe2O3),加入过量稀硫酸酸溶过滤,滤液为硫酸铝、硫酸亚铁、硫酸铁,残渣为二氧化硅和不溶性杂质,过滤后在滤液中加入稍过量高锰酸钾溶液氧化亚铁离子为铁离子,用氧化铝或氢氧化铝调节溶液PH使铁离子全部沉淀,铝离子不沉淀,得固体A为氢氧化铁,溶液A中含有铝离子,溶液A中加入氨水后得固体B为氢氧化铝,固体B中加入稀硫酸得硫酸铝溶液,再将硫酸铝溶液蒸发浓缩、降温结晶过滤洗涤得到硫酸铝钾晶体,溶液B中含有锰离子和硫酸根离子,硫酸锰固体溶于碳酸氢铵溶液可得碳酸锰沉淀,
(1)为提高酸浸速率,可以适当提高硫酸的浓度、加热、搅拌等,根据上面的分析可知,残渣的主要成分是SiO2,
故答案为:适当提高硫酸的浓度、加热、搅拌;SiO2;
(2)图中氧化过程就是高锰酸钾将亚铁离子氧化为铁离子,反应的离子方程式为MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,
故答案为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
(3)根据上面的分析可知,试剂X的化学式是Al2O3或Al(OH)3,要使铁离子完全沉淀且铝离子不能沉淀,所以pH的调控范围是3.2≤pH<3.6,
故答案为:Al2O3或Al(OH)3;3.2≤pH<3.6;
(4)操作Ⅱ就是从硫酸铝溶液中得到硫酸铝晶体,步骤为 蒸发浓缩、降温结晶、过滤洗涤、低温干燥,若操作Ⅰ与操作Ⅱ相同,则洗涤三草酸合铁酸钾以获得干燥晶体的试剂最好是先冷水后酒精,这样即可以除去可溶性杂质,又可以减小三草酸合铁酸钾的溶解,又便于干燥,故选b,
故答案为:蒸发浓缩、降温结晶;b;
(5)生成MnCO3沉淀的离子方程式为Mn2++2HCO3-=MnCO3↓+H2O+CO2↑,故答案为:Mn2++2HCO3-=MnCO3↓+H2O+CO2↑.
点评 本题考查了流程分析,反应过程理解应用,反应现象和产物的判断,注意基本实验的操作步骤,离子方程式书写等,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 双氧水可用于皮肤伤口消毒 | |
| B. | 水玻璃是制备硅胶和木材防火剂等的原料 | |
| C. | 生石灰和铁粉都是食品包装中常用的干燥剂 | |
| D. | 生活中可用电解饱和食盐水的方法制取消毒液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
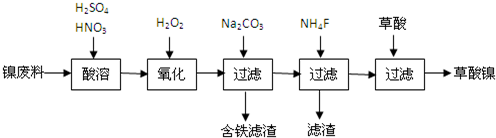

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 请认真观察图,然后回答问题:
请认真观察图,然后回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
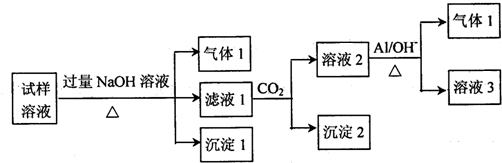
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 金属离子 | Fe3+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 6.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com