
| A、放在南极 | B、放在海边 | C、表面镀上一层铬 | D、和锌片连在一起放置在水中 |
科目:高中化学 来源: 题型:阅读理解
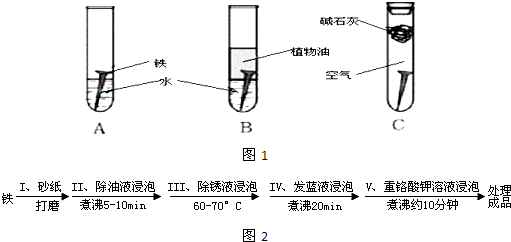
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、轮船水线以下的船壳上镶嵌有一定量的锌块 | B、镀锌的铁制品比镀锡的铁制品耐用 | C、埋在潮湿疏松土壤里的铁管比埋在干燥致密不透气的土壤里的铁管更易被腐蚀 | D、在空气中,金属银的表面生成一层黑色物质 |
查看答案和解析>>
科目:高中化学 来源:0102 模拟题 题型:单选题
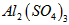 溶液和向
溶液和向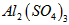 溶液中滴加氨水现象相同
溶液中滴加氨水现象相同 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com