
| A. | 用过量氨水吸收工业尾气中的SO2:2NH3•H2O+SO2═2NH4++SO32-+H2O | |
| B. | 铜与浓硫酸混合加热:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO42-+2H2O+SO2↑ | |
| C. | 过量的浓盐酸与铁屑反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 明矾溶液中滴加氢氧化钡溶液使沉淀质量最大:Al3++2SO42-+2Ba2++3OH-═2BaSO4↓+Al(OH)3↓ |
分析 A.反应生成亚硫酸铵和水;
B.反应生成硫酸铜、二氧化硫和水;
C.反应生成氯化亚铁和氢气;
D.使沉淀质量最大,生成硫酸钡和偏铝酸钾.
解答 解:A.用过量氨水吸收工业尾气中的SO2的离子反应为2NH3•H2O+SO2═2NH4++SO32-+H2O,故A正确;
B.铜与浓硫酸混合加热的离子反应为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO42-+2H2O+SO2↑,故B正确;
C.过量的浓盐酸与铁屑反应的离子反应为Fe+2H+═Fe2++H2↑,故C错误;
D.明矾溶液中滴加氢氧化钡溶液使沉淀质量最大:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O,故D错误;
故选AB.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 操作和现象 | 结论 | |
| A. | 将大小相同的K和Na放入等体积的水中,钾比钠反应剧烈 | 钾元素的金属性比钠元素强 |
| B. | 将Ba(OH)2•8H2O和NH4Cl晶体在小烧杯中混合搅拌,用手触摸烧杯外壁感觉变凉 | Ba(OH)2•8H2O与NH4Cl的反应是吸热反应 |
| C. | 在催化剂存在的条件下,石蜡油加强热生成的气体通入溴的四氯化碳溶液中,溶液褪色 | 石蜡油的分解产物都是烯烃 |
| D. | 向盛有H2O2溶液的试管中,加入少量FeCl3溶液,产生气泡的速率比不加FeCl3溶液的快 | FeCl3可以加快H2O2分解的速率,起了催化作用 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.2mol/L | B. | 2.0mol/L | C. | 2.4mol/L | D. | 3.0mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含1mol溶质的任何溶液,物质的量浓度一定相等 | |
| B. | 体积相同,物质的量浓度相同的同种溶液所含溶质的粒子数一定相同 | |
| C. | 1L0.5mol•L-1CaCl2溶液中,Ca2+与Cl-的物质的量浓度都是0.5mol•L-1 | |
| D. | 从1L0.2mol•LNaOH溶液中取出100ml,这100ml溶液的物质的量浓度是0.02mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
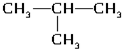 (4)氯气(5)
(4)氯气(5)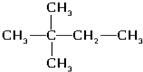 (6)氯水
(6)氯水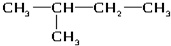 (8)
(8) (9)${\;}_{17}^{35}$Cl
(9)${\;}_{17}^{35}$Cl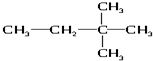
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| E(kJ•mol-1) | 460 | 360 | 436 | 431 | 176 | 347 |
| A. | 吸收412 kJ•mol-1 | B. | 放出412 kJ•mol-1 | ||
| C. | 吸收236 kJ•mol-1 | D. | 放出236 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com