
元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p 轨道上有4个电子。元素Z 的原子最外层电子数是其内层的3倍。
(1)X与Y所形成化合物晶体的晶胞如图所示。
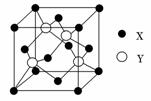
①在1个晶胞中,X离子的数目为________。
②该化合物的化学式为________。
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是________。
(3)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是________。
(4)Y与Z可形成YZ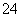 。
。
①YZ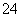 的空间构型为________(用文字描述)。
的空间构型为________(用文字描述)。
②写出一种与YZ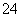 互为等电子体的分子的化学式:________。
互为等电子体的分子的化学式:________。
(5)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1 mol该配合物中含有σ键的数目为________。
解析:本题主要考查原子结构与性质知识,意在考查考生的空间想象能力及对物质结构和性质的理解能力。X的核外电子排布式为1s22s22p63s23p63d104s2,X为Zn;Y的核外电子排布式为1s22s22p63s23p4,Y为S;根据Z的信息可知Z为O。(1)①由晶胞结构可知,X分别位于晶胞的顶点和面心,根据晶胞中原子的“分摊法” 可计算一个晶胞中的X原子数为:8×1/8+6×1/2=4。②Y原子全部在晶胞中,故一个晶胞中含有4个Y原子。故该化合物的化学式为ZnS。(2)H2S分子中S原子有两对成键电子和两对孤对电子,所以H2S分子中S原子的轨道杂化类型为sp3杂化。(3)H2O与乙醇可以形成分子间氢键,使得水与乙醇互溶;而H2S与乙醇不能形成分子间氢键,故H2S在乙醇中的溶解度小于H2O。(4)①SO
可计算一个晶胞中的X原子数为:8×1/8+6×1/2=4。②Y原子全部在晶胞中,故一个晶胞中含有4个Y原子。故该化合物的化学式为ZnS。(2)H2S分子中S原子有两对成键电子和两对孤对电子,所以H2S分子中S原子的轨道杂化类型为sp3杂化。(3)H2O与乙醇可以形成分子间氢键,使得水与乙醇互溶;而H2S与乙醇不能形成分子间氢键,故H2S在乙醇中的溶解度小于H2O。(4)①SO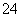 的中心原子S周围有4对成键电子,形成以S为体心,O为顶点的正四面体结构;②SO
的中心原子S周围有4对成键电子,形成以S为体心,O为顶点的正四面体结构;②SO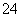 中S、O最外层均为6个电子,故SO
中S、O最外层均为6个电子,故SO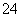 中原子最外层共有32个电子;CCl4、SiCl4中原子的最外层电子总数均为4+7×4=32,故SO
中原子最外层共有32个电子;CCl4、SiCl4中原子的最外层电子总数均为4+7×4=32,故SO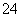 、CCl4、SiCl4为等电子体。(5)[Zn(NH3)4]Cl2中[Zn(NH3)4]2+与Cl-形成离子键,而[Zn(NH3)4]2+中含有4个Zn—N键(配位键)和12个N—H键,共16个共价单键,故1 mol该配合物中含有16 mol σ键。
、CCl4、SiCl4为等电子体。(5)[Zn(NH3)4]Cl2中[Zn(NH3)4]2+与Cl-形成离子键,而[Zn(NH3)4]2+中含有4个Zn—N键(配位键)和12个N—H键,共16个共价单键,故1 mol该配合物中含有16 mol σ键。
答案:(1)①4 ②ZnS
(2)sp3
(3 )水分子与乙醇
)水分子与乙醇 分子之间形成氢键
分子之间形成氢键
(4)①正四面体 ②CCl4或SiCl4等
(5)16NA或16×6.02×1023个


科目:高中化学 来源: 题型:
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是: 。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
 B.2H2(g)+O2(g)=2H2O(1) △H<0
B.2H2(g)+O2(g)=2H2O(1) △H<0
C. NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
(2)以H2SO4溶液为电解质溶液,依据所选反应设计一个原电池,
其正极的电极反应式为
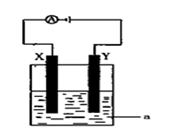
(3)现将你设计的原电池通过导线与下图中电解池相连,其中a为
电解液,X和Y均为惰性电极,则:
①若a为CuSO4溶液,则电解时的化学反应方程式为 。
②若电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,当阳极产生的气体为672 mL(标准状况下)时,溶液的pH = (假设电解后溶液体积不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
若NA表示阿佛加德罗常数,下列说法错误的是
A.一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数一定为0.1NA
B.标准状况下1 mol Cl2反应得到的电子数一定为2NA
C.常温下,2.7g铝与足量的氢氧化钠溶液反应,失去的电子数一定为0.3NA
D.在20℃,101kPa时,4.6gNO2、N2O4的混合气体一定含0.2NA个氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
铁是应用最广泛的金属,铁的卤化物、氧化物等均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用实验的方法。实验中称取0.54 g的FeClx样品,溶解后加入足量硝酸银溶液,得沉淀1.435g。求出FeClx中x值 (列出计算过程);
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe):n(C1)=1:2.1,则该样品中FeCl3的物质的量分数为__________。在实验室中,FeCl2可用铁粉和__________反应制备
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为____________;
查看答案和解析>>
科目:高中化学 来源: 题型:
“脑黄金”可谓是家喻户晓,其实脑黄金(DHA)就是从深海鱼油中提取出的不饱和程度很高的脂肪酸,它的分子中有6个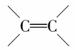 ,称为二十六碳六烯酸,则其甘油酯的结构简式为
,称为二十六碳六烯酸,则其甘油酯的结构简式为
( )
A.(C25H51COO)3C3H5 B.(C25H39COO)3C3H5
C.(C26H41COO)3C3H5 D.(C26H47COO)3C3H5
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
A.含有NA个氧原子的氧气在标准状况下的体积约为22.4 L
B.2 L 0.3 mol·L-1的硫酸钾溶液中钾离子浓度为1.2 mol·L-1
C.常温常压下,32 g O2和O3的混合气体所含原子数为2NA
D.25℃,1.01×105Pa,64 g SO2中含有的原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
门捷列夫制作元素周期表时,许多元素尚未发现,他在铝的下面留了空位给“类铝”,并对“类铝”的性质进行了预测, “类铝”与后发现的镓的性质一致,从而验证了元素周期表的正确性。下列有关镓的性质的描述中错误的是 ( )
 A.镓的金属性比铝弱 B.镓的常见化合价为+3
A.镓的金属性比铝弱 B.镓的常见化合价为+3
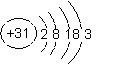
C.镓的原子半径比铝大 D.镓的原子结构示意图为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com