
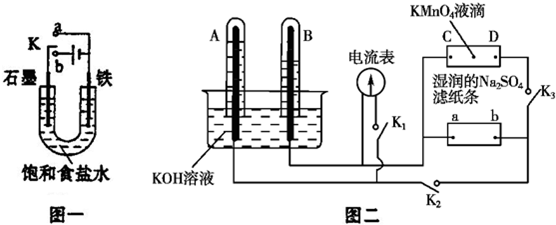
分析 Ⅰ.(1)若开始时开关K与a连接,该装置构成原电池,发生电化学腐蚀中的吸氧腐蚀,正极上氧气发生还原反应;
(2)若开始时开关K与b连接时,两极均有气体产生,则Fe作阴极,石墨作阳极,阳极上氯离子放电、阴极上氢离子放电;
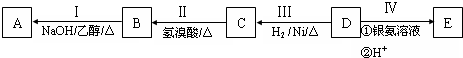
Ⅱ.电解KOH溶液时,阳极上生成氧气、阴极上生成氢气,且氧气和氢气体积之比为1:2,根据图知,A中气体是氧气、B中气体是氢气,则A中电极为阳极、B中电极为阴极;
(1)连接阳极的电极是正极、连接阴极的电极是负极;
(2)高锰酸钾溶液中高锰酸根离子呈红色,电解过程中,阳离子向阴极移动、阴离子向阳极移动;
(3)若A、B中均有气体包围电极,此时切断K2、K3,闭合K1,电流表的指针偏转,说明构成原电池,有氢气的电极是负极、有氧气的电极是正极,正极上氧气得电子和水反应生成氢氧根离子.
解答 解:Ⅰ.(1)开关K与a连接,为原电池,NaCl溶液为中性,发生吸氧腐蚀,正极上氧气得电子发生还原反应,电极反应式为O2+4e-+2H2O=4OH-,故答案为:吸氧;
(2)K与b连接,为电解池,若开始时开关K与b连接时,两极均有气体产生,则Fe作阴极,石墨作阳极,氯离子、氢离子放电,则N为电源负极,电解的总离子反应为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑,
故答案为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑;
Ⅱ、电解KOH溶液时,阳极上生成氧气、阴极上生成氢气,且氧气和氢气体积之比为1:2,根据图知,A中气体是氧气、B中气体是氢气,则A中电极为阳极、B中电极为阴极;
(1)连接阳极的电极是正极、连接阴极的电极是负极,a连接阴极,则a是负极,
故答案为:负;
(2)高锰酸钾溶液中高锰酸根离子呈红色,电解过程中,阳离子向阴极移动、阴离子向阳极移动,电解时,硫酸钠溶液和铂电极构成电解池,C是阴极、D是阳极,所以高锰酸根离子向阳极D电极移动,则看到的现象是紫色向D方向移动,两个电极有气体生成,
故答案为:紫色向D方向移动,两极有气体产生;
(3)若A、B中均有气体包围电极,此时切断K2、K3,闭合K1,电流表的指针偏转,说明构成原电池,有氢气的电极是负极、有氧气的电极是正极,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为O2+2H2O+4e-=4 OH-,
故答案为:O2+2H2O+4e-=4 OH-.
点评 本题考查了原电池和电解池原理,明确离子放电顺序,根据各个电极上发生的反应来分析解答,把握电解质溶液的酸碱性确定生成的离子或物质,为易错点,正确判断正负极、阴阳极是解本题关键,知道各个电极上发生的反应,难点是电极反应式的书写,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | O2、I2、Hg | B. | CO2、NaCl、KCl、Si | C. | HF、HCl、HBr | D. | 镁铝合金、Mg、Al |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅用AgNO3溶液便可鉴别亚硝酸钠和食盐 | |
| B. | 重结晶时,溶液冷却速度越慢得到的晶体颗粒越大 | |
| C. | 乙酸与乙醇的混合液可用分液漏斗进行分离 | |
| D. | 醇都能发生取代反应,也都能发生消去和氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 ;
;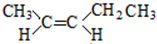 和
和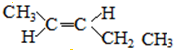 ;
;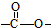 结构的有12种;E的另一种同分异构体能发生银镜反应,能与足量金属钠生成氢气,不能发生消去反应,其结构简式为
结构的有12种;E的另一种同分异构体能发生银镜反应,能与足量金属钠生成氢气,不能发生消去反应,其结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| B. | 过滤时,引流的玻璃棒下端触在三层滤纸处 | |
| C. | 蒸馏中,冷却水应从冷凝管的下口通入,上口流出 | |
| D. | 用pH试纸测溶液的酸性时,应先将试纸用蒸馏水润湿 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com