
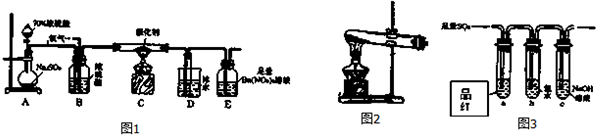
分析 (1)氧化还原反应中,化合价升高的元素在反应中被氧化,结合氧化还原反应电子转移总数计算生成标准状况下的体积为4.48L时,转移电子数;
(2)①装置是固体和固体加热反应制备气体的装置,可以是氯酸钾在二氧化锰催化剂作用下受热分解可以获得氧气;
②装置D增加的质量为ng,即生成三氧化硫的质量是ng,物质的量是$\frac{ng}{80g/mol}$,装置E中产生白色沉淀的质量为mg,依据硫元素守恒计算二氧化硫的转化率;
(3)①二氧化硫具有漂白性,可以使品红溶液褪色;
②氯气具有氧化性,可以将二氧化硫氧化到最高价的硫酸;
解答 解:(1)氧化还原反应4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$8SO2+2Fe2O3中,化合价升高的Fe、S元素在反应中被氧化,氧元素化合价0价变化为-2价,铁元素和硫元素化合价升高,生成8molSO2反应电子转移总数为44mol,当该反应生成的二氧化硫在标准状况下的体积为4.48L时,物质的量=$\frac{4.48L}{22.4L/mol}$=0.2mol,电子转移总数=$\frac{0.2mol×44}{8}$=1.1mol,
故答案为:Fe、S;1.1;
(2)①用图2所示装置制取氧气,即加热固体的方法制氧气,可以让氯酸钾在二氧化锰催化下受热分解获得氧气,方程式为:2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑,
故答案为:2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑;
②装置D增加的质量为ng,即生成三氧化硫的质量是ng,物质的量是$\frac{ng}{80g/mol}$,装置E中产生白色沉淀的质量为mg,则吸收的二氧化硫的物质的量是$\frac{mg}{233g/mol}$,则二氧化硫的转化率=$\frac{\frac{n}{80}mol}{\frac{n}{80}mol+\frac{m}{233}mol}$×100%,
故答案为:$\frac{\frac{n}{80}mol}{\frac{n}{80}mol+\frac{m}{233}mol}$×100%;
(3)①二氧化硫具有漂白性,可以红色品红溶液褪色,
故答案为:红色品红溶液褪色;漂白性;
②方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成,可能是氯水中的氯离子产生的作用,
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去,可以是氯水中含有的漂白性物质次氯酸起的作用;
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀,证明溶液中会出现硫酸根离子,是二氧化硫在酸性环境下和氯水反应生成的,即SO2+Cl2+2H2O=4H++SO42-+2Cl-,上述方案中合理的是Ⅲ,
故答案为:Ⅲ.
点评 本题考查了二氧化硫性质应用和实验验证,实验设计的步骤和实验方案的确定应根据题干要求分析判断,关键是读懂题干信息,依据题干条件计算判断,题目难度中等.


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 氧化钠的电子式: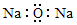 | |
| B. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{80}$Br | |
| C. | 硫离子的结构示意图: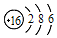 | |
| D. | CCl4的球棍模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | W | |
| 起始状态(mol) | 2 | 1 | 0 |
| 平衡状态(mol) | 1 | 0.5 | 1.5 |
| A. | 该温度下,该反应的平衡常数K=9 | |
| B. | 升高温度,若W的体积分数减小,此反应△H>0 | |
| C. | 该温度下,该反应的方程式为 2X(g)+Y(g)?3W(g) | |
| D. | 增大压强,正、逆反应速率都增大,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 加热方式 | 产物元素组成 | 各元素的质量分数% | |
| Fe | O | ||
| 酒精灯 | Fe和O | 74.50 | 25.50 |
| 带网罩酒精灯 | Fe和O | 76.48 | 23.52 |
| 酒精喷灯 | Fe | 100.00 | 0.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
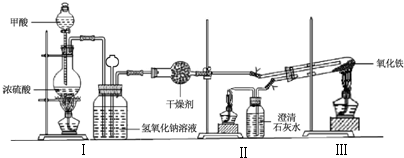
 用如图所示装置制取乙酸乙酯.请回答下列问题:
用如图所示装置制取乙酸乙酯.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
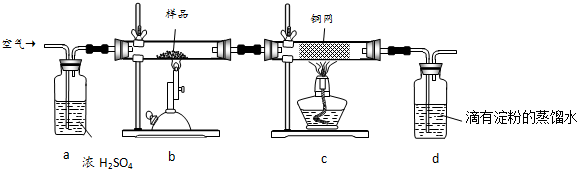

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 过氧化钠和水反应:2O22-+2H2O=4OH-+O2↑ | |
| B. | 含等物质的量的KHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| C. | 向氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 硫化钠水溶液呈碱性:S2-+H2O?HS-+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 纯净物 | 混合物 | 电解质 | 非电解质 | |
| A | 硫酸 | 水煤气 | 硫酸 | 铜 |
| B | 胆矾 | 碱石灰 | 硫酸钡 | NH3 |
| C | 纯碱 | 蔗糖溶液 | 氯化钠溶液 | 三氧化硫 |
| D | 冰醋酸 | 氢氧化铁胶体 | 苛性钾溶液 | 乙醇 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com