
(9分)某学生用0.1×10×25mm3,质量分数≥99.5%的铝片和盐酸反应制取H2,实验现象见下表:
(1)写出铝片与盐酸、硫酸反应的离子方程式
(2)反应1~15min内,铝与盐酸的反应速率逐渐加快,15~20min内,反应速率逐渐减小。其原因是
(3)①根据铝片与盐酸和硫酸反应现象的差异,有学生对此现象提出如下猜想(至少要写出两种假设):
假设一:Cl-对该反应有促进作用,对该反应不影响。
假设二: 。
假设三: 。]
假设四: 。
① 请你以“假设一”为实验课题,设计实验方案探究,要求写出主要实验步骤。
②将NaCl颗粒加入Al片与稀盐酸反应液中,看反应速率有无变化及变化情况,来判断Cl-是否对反应起作用。若速率加快,说明Cl-对该反应有促进作用;若速率不变,说明Cl-对该反应的速率不影响。将K2SO4颗粒加入Al片与稀H2SO4反应液中,看反应速率有无变化及变化情况,来判断是否对反应起作用。若速率减小,说明
对该反应有抑制作用;若速率不变,说明
对该反应的速率不影响。(3分)
解析:本题属于开放性试题,要求学生结合具体的实验情境,作出推断和假设,设问角度新颖,考查学生了解科学研究的基本思路和方法。(3)中答案也可能多种多样。如“对金属铝与H+反应有抑制作用”或“
对金属铝与H+反应没有影响”或“带低电荷的阴离子对金属铝与H+反应有促进作用”等等。


科目:高中化学 来源: 题型:
| 1min | 2min | 5min | 15min | 20min | |
| 3mol/L HCl | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
| 1.5mol/L H2SO4 | 均无明显现象(只有少量气泡) | ||||
查看答案和解析>>
科目:高中化学 来源:2011-2012学年安徽省濉溪县临涣中学高二上学期期中联考化学试卷 题型:实验题
(9分)某学生用0.1×10×25mm3,质量分数≥99.5%的铝片和盐酸反应制取H2,实验现象见下表: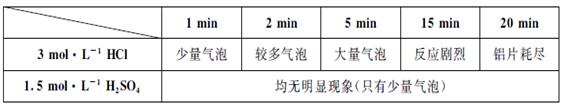
(1)写出铝片与盐酸、硫酸反应的离子方程式
(2)反应1~15min内,铝与盐酸的反应速率逐渐加快,15~20min内,反应速率逐渐减小。其原因是
(3)①根据铝片与盐酸和硫酸反应现象的差异,有学生对此现象提出如下猜想(至少要写出两种假设):
假设一:Cl-对该反应有促进作用,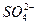 对该反应不影响。
对该反应不影响。
假设二: 。
假设三: 。]
假设四: 。
③ 请你以“假设一”为实验课题,设计实验方案探究,要求写 出主要实验步骤。
出主要实验步骤。
查看答案和解析>>
科目:高中化学 来源:2013届安徽省高二上学期期中联考化学试卷 题型:实验题
(9分)某学生用0.1×10×25mm3,质量分数≥99.5%的铝片和盐酸反应制取H2,实验现象见下表:

(1)写出铝片与盐酸、硫酸反应的离子方程式
(2)反应1~15min内,铝与盐酸的反应速率逐渐加快,15~20min内,反应速率逐渐减小。其原因是
(3)①根据铝片与盐酸和硫酸反应现象的差异,有学生对此现象提出如下猜想(至少要写出两种假设):
假设一:Cl-对该反应有促进作用, 对该反应不影响。
对该反应不影响。
假设二: 。
假设三: 。]
假设四: 。
① 请你以“假设一”为实验课题,设计实验方案探究,要求写出主要实验步骤。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 1min | 2min | 5min | 15min | 20min | |
| 3mol/L HCl | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
| 1.5mol/L H2SO4 | 均无明显现象(只有少量气泡) | ||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com