
| A.往CrCl3溶液加入过量NaOH溶液可制得Cr(OH)3 |
| B.对CrCl3·6H2O加热脱水可得CrCl3 |
| C.Cr2O3既能溶于酸,又能溶于NaOH溶液 |
| D.CrO- 2水解使溶液显酸性 |
科目:高中化学 来源:不详 题型:单选题
| A.合金中镁的质量分数为63.3%≤Mg%<100% |
| B.该合金中含有铝的质量至少为5.4 g |
| C.在产生沉淀后的溶液中一定含有0.2 mol NaAlO2 |
| D.在产生沉淀后的溶液中有1.5 mol Na2SO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 | 元素性质或原子结构 |
| A | 单质为生活中常见的金属,该金属的两种黑色氧化物(其中一种有磁性)的相对分子质量相差160 |
| B | 单质为生活中常见的金属,其相对原子质量比A大8 |
| C | 地壳中含量最多的金属元素 |
| D | 元素的主族序数是其所在周期序数的3倍 |
| E | E的某种原子的原子核内没有中子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
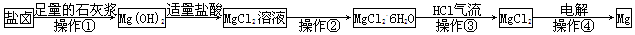
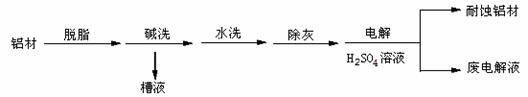
| A.操作①发生的反应为非氧化还原反应 |
| B.若在实验室进行操作①只需要漏斗和烧杯两种玻璃仪器 |
| C.操作②是蒸发浓缩结晶 |
| D.在整个制备过程中,未发生置换反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铝热剂就是单指Fe2O3粉和铝粉的混合物 |
| B.检验从火星上带回来的红色物质是否是Fe2O3的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液 |
| C.还原amol Fe2O3所需H2、Al、CO的物质的量之比为3:2:3 |
| D.明矾属于硫酸盐,含结晶水,是混合物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 4AlCl3+3O2
4AlCl3+3O2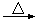 AlCl3+X↑,为确定气体X是否是混合气体,某同学将X依次通过灼热的氧化铜和澄清的石灰水,再根据现象判断。该操作是否正确?(填正确、不正确或无法判断) ,请说明理由 。
AlCl3+X↑,为确定气体X是否是混合气体,某同学将X依次通过灼热的氧化铜和澄清的石灰水,再根据现象判断。该操作是否正确?(填正确、不正确或无法判断) ,请说明理由 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
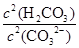 填(“变大”、“变小”或“不变”)
填(“变大”、“变小”或“不变”)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.②③ | B.③④ | C.①④ | D.②④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
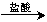 测定生成的气体在标准状况下的体积
测定生成的气体在标准状况下的体积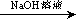 测定生成的气体在标准状况下的体积
测定生成的气体在标准状况下的体积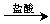 溶液
溶液 过滤,测定得到沉淀的质量
过滤,测定得到沉淀的质量| A.都能 | B.都不能 |
| C.①不能,其它都能 | D.②③不能,①能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com