
【题目】某化学兴趣小组对加碘食盐中碘酸钾进行研究,查阅资料得知:碘酸钾是一种白色粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下碘酸钾是一种较强的氧化剂与HI、H2O2等物质作用,被还原为单质碘。
(1)学生甲设计实验测出加碘食盐中碘元素的含量,步骤如下:
①称取wg加碘盐,加适量蒸馏水溶解。
②用稀硫酸酸化所得的溶液,再加入过量KI溶液,写出该步反应的离子方程式:_______。
③以淀粉为指示剂,用物质的量浓度为1.00×10-3molL-1的Na2S2O3溶液滴定![]() 滴定时的反应方程式为
滴定时的反应方程式为![]() ,滴定时Na2S2O3溶液应放在 ______
,滴定时Na2S2O3溶液应放在 ______ ![]() 填“酸式滴定管”或“碱式滴定管”
填“酸式滴定管”或“碱式滴定管”![]() ,滴定至终点的现象为_______________。
,滴定至终点的现象为_______________。
(2)学生乙对纯净的NaCl(不含KIO3)进行了下列实验:
顺序 | 步骤 | 实验现象 |
① | 取少量纯净的NaCl,加适量蒸馏水溶解 | 溶液无变化 |
② | 滴入少量淀粉-KI溶液,振荡 | 溶液无变化 |
③ | 然后再滴加稀硫酸,振荡 | 溶液变蓝色 |
请推测实验③中产生蓝色现象的可能原因: __________________ ;根据学生乙的实验结果可推测学生甲的实验结果可能 ______ (填“偏大”、“偏小”或“无影响”)。
(3)学生丙设计实验证明加碘食盐样品中碘元素的存在形式是IO3-而不是I-,进行如下实验。写出实验步骤、预期现象和结论。限选试剂:稀硫酸、稀硝酸、3% H2O2溶液、新制氯水、1%淀粉溶液、蒸馏水。
实验步骤 | 预期现象和结论 |
步骤1:取少量食盐样品于试管中,加适量蒸馏水使其完全溶解, _____________________ | ______ |
步骤2:另取少量食盐样品于试管中,加适量蒸馏水使其完全溶解,滴入适量的稀硫酸酸化, _____________________ | ______ |
【答案】![]() 碱式滴定管 溶液由蓝色变成无色,且半分钟内不变色 I-在酸性条件下能被溶解在溶液中的氧气氧化成I2 偏大 加入几滴新制的氯水,再加入1-2滴1%淀粉溶液,充分振荡; 溶液不呈蓝色,则溶液中无I-,碘元素的存在形式不是I- 再加入少量3%H2O2溶液和1-2滴1%淀粉溶液,充分振荡 溶液呈蓝色,则溶液中存在IO3-,碘元素的存在形式为IO3-
碱式滴定管 溶液由蓝色变成无色,且半分钟内不变色 I-在酸性条件下能被溶解在溶液中的氧气氧化成I2 偏大 加入几滴新制的氯水,再加入1-2滴1%淀粉溶液,充分振荡; 溶液不呈蓝色,则溶液中无I-,碘元素的存在形式不是I- 再加入少量3%H2O2溶液和1-2滴1%淀粉溶液,充分振荡 溶液呈蓝色,则溶液中存在IO3-,碘元素的存在形式为IO3-
【解析】
(1)②用稀硫酸酸化所得的溶液,再加入过量KI溶液,反应生成碘单质;
③ Na2S2O3为强碱弱酸盐,S2O32-水解使溶液呈弱碱性;滴定结束前溶液为蓝色,![]() 反应完毕时溶液蓝色褪色;
反应完毕时溶液蓝色褪色;
(2)酸性条件下,碘离子被氧气氧化生成碘单质;甲同学的实验中,若用稀硫酸酸化,再加入过量KI溶液,由于碘单质的量增大;
(3)步骤1:氯气氧化性大于碘单质,用氯水检验食盐中存不存在碘离子,
步骤2:用双氧水和淀粉检验食盐中含有碘酸根离子;
(1)②用稀硫酸酸化所得的溶液,再加入过量KI溶液,反应生成碘单质,反应的离子方程式为:![]() ;
;
③ Na2S2O3为强碱弱酸盐,因为硫代硫酸根离子水解,Na2S2O3溶液呈弱碱性,所以滴定时Na2S2O3溶液应放在碱性滴定管中;滴定结束前溶液为蓝色,I2反应完毕时溶液蓝色褪色,则滴定终点现象为:溶液由蓝色变成无色,且半分钟内不变色;
(2)酸性条件下,碘离子被氧气氧化生成碘单质,离子反应方程式为:![]() ,在酸性条件下,过量的碘离子易被空气中氧气氧化生成碘单质;甲同学的实验中,若用稀硫酸酸化,再加入过量KI溶液,由于碘单质的量增大,导致测定结果偏大;
,在酸性条件下,过量的碘离子易被空气中氧气氧化生成碘单质;甲同学的实验中,若用稀硫酸酸化,再加入过量KI溶液,由于碘单质的量增大,导致测定结果偏大;
(3)步骤1:氯气氧化性大于碘单质,用氯水检验食盐中存不存在碘离子,操作方法及现象为:取少量食盐样品于试管中,加适量蒸馏水使其完全溶解,加入几滴新制的氯水,再加入1-2滴1%淀粉溶液,充分振荡,若溶液不呈蓝色,则溶液中无I-,碘元素的存在形式不是I-;
步骤2:用双氧水和淀粉检验食盐中含有碘酸根离子,操作方法及现象为:另取少量食盐样品于试管中,加适量蒸馏水使其完全溶解,滴入适量的稀硫酸酸化,再加入少量3%H2O2溶液和1-2滴1%淀粉溶液,充分振荡,若溶液呈蓝色,则溶液中存在IO3-,碘元素的存在形式为IO3-。


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
【题目】根据部分短周期元素的信息回答问题。
元素 | 元素信息 |
| 第3周期ⅥA族 |
| 族序数是周期数的3倍 |
| 原子序数是11 |
|
|
(1)![]() 、
、![]() 的元素符号分别为______、______,
的元素符号分别为______、______,![]() 、
、![]() 的元素名称分别为______、______。
的元素名称分别为______、______。
(2)写出![]() 、
、![]() 的常见单质在加热时的反应方程式:______。
的常见单质在加热时的反应方程式:______。
(3)从原子结构的角度分析,![]() 原子与
原子与![]() 原子的______相同,
原子的______相同,![]() 原子与
原子与![]() 原子的______相同。
原子的______相同。
查看答案和解析>>
科目:高中化学 来源: 题型:
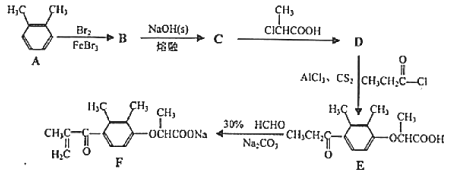
【题目】化合物F是一种药物合成的中间体,F的一种合成路线如下:
已知:
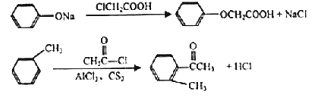
回答下列问题:
(1)![]() 的名称为____。
的名称为____。
(2)D中含氧官能团的名称为____。
(3)B→C的反应方程式为____。
(4)D→E的反应类型为____。
(5)C的同分异构体有多种,其中苯环上连有—ONa、2个—CH3的同分异构体还有____种,写出核磁共振氢谱为3组峰,峰面积之比为6:2:1的同分异构体的结构简式____。
(6)依他尼酸钠(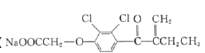 )是一种高效利尿药物,参考以上合成路线中的相关信息,设计以
)是一种高效利尿药物,参考以上合成路线中的相关信息,设计以![]() 为原料(其他原料自选)合成依他尼酸钠的合成路线。________________
为原料(其他原料自选)合成依他尼酸钠的合成路线。________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列表格,回答有关问题:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
一 | ||||||||
二 | a | b | c | d | ||||
三 | e | f | g | h | i | j | k | l |
(1)上表中,a元素的元素符号为____,第一电离能最小的元素是____(填元素名称,下同),电负性最大的元素是___。
(2)这些元素的最高价氧化物对应的水化物中,酸性最强的是____(填化学式,下同),碱性最强的是_____。
(3)某元素最高价氧化物对应的水化物呈两性,则该元素是/span>_____(填对应的字母),该元素与c元素形成的化合物能否与NaOH溶液反应(若能,写出相应的离子方程式;若不能,则填“否”)_______。
(4)在e~k元素的原子中,原子半径最小的是_____(填元素符号),其价电子排布式为_________;未成对电子数最多的是____(填元素符号),其最高价氧化物对应水化物的化学式为_____;有两个未成对电子的元素是____(填元素符号);M层有两个空轨道的是____(填元素符号),其阳离子结构示意图为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同条件下,用O2氧化一定浓度的FeCl2溶液过程中所测的实验数据如图所示。下列分析或推测不合理的是( )
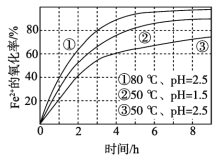
A.Fe2+的氧化率随时间延长而逐渐增大
B.由①和③可知,温度越高,Fe2+氧化速率越快
C.由②和③可知,pH越大,Fe2+氧化速率越快
D.氧化过程的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,某可逆反应的正反应速率和逆反应速率随时间变化的曲线如下 ,下列有关说法不正确的是

A.t1 时刻,反应向逆反应方向进行
B.t2 时刻,正反应速率大于逆反应速率
C.t3 时刻,反应刚好达到平衡状态
D.t4时刻,反应限度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表中短周期的一部分,关于Y、Z、M的说法正确的是( )

A.电负性:Z>M>Y
B.离子半径:M->Z2->Y-
C.ZM2分子中各原子的最外层均满足8电子稳定结构
D.Z元素基态原子最外层电子轨道表示式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】S2Cl2是橙黄色液体,少量泄漏会产生窒息性气体,喷水雾可减慢其挥发,并产生酸性悬浊液。其分子结构如图所示。下列关于S2Cl2的说法中错误的是( )

A.S2Cl2为非极性分子
B.分子中既含有极性键又含有非极性键
C.与S2Br2结构相似,熔、沸点S2Br2>S2Cl2
D.与水反应的化学方程式可能为2S2Cl2+2H2O===SO2↑+3S↓+4HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究同主族非金属元素性质的递变规律,某研究性学习小组的甲同学设计了如图所示的实验装置,其中A装置内可生成Cl2。

(1)甲同学的部分实验记录如下:B处棉花变成蓝色;C处棉花变成橙红色。甲同学由此现象得出的结论是同主族从上到下元素的非金属性减弱。
①B处发生反应的化学方程式为_________。
②甲同学的结论是________(填“正确”或“不正确”)的,理由是____________________。
(2)乙同学认为应将甲同学实验中B、C两处的棉花调换位置,用氯气先置换出溴,然后溴再与KI接触,以判断Br2与KI能否发生反应。该设想是________(填“合理”或“不合理”)的,原因是___
(3)丙同学在甲同学的实验结束后,取出C处的棉花,将其与另一个沾有淀粉KI溶液的棉花(E)接触,发现E慢慢出现蓝色,结合甲的实验现象,他认为可以确定同主族元素非金属性的递变规律,你同意此种观点吗?______(填“同意”或“不同意”),理由是__________
(4)丁同学综合分析了前面几位同学的实验,认为若将沾有Na2S溶液的棉花置于玻璃管中适当的位置,此实验还可以同时探究同周期元素性质的递变规律,他提出此观点的依据是___,预期的现象与结论是___________,相应反应的离子方程式为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com