
科目:高中化学 来源: 题型:选择题
| A. | 人类目前所直接利用的能量大部分是由化学反应产生的 | |
| B. | 人体运动所消耗的能量与化学反应无关 | |
| C. | 我国目前最主要的能源是煤炭 | |
| D. | 煤、石油、天然气是当今世界最重要的三种化石燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaH在水中显酸性 | |
| B. | NaH中氢离子半径比锂离子半径大 | |
| C. | NaH中氢离子可被还原为氢气 | |
| D. | Na与其它碱金属都必须保存在煤油中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
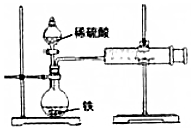 某小组的同学们利用如图装置,探究不同条件对铁与酸反应速率的影响.
某小组的同学们利用如图装置,探究不同条件对铁与酸反应速率的影响.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2与CO2反应生成Na2CO3:Na2O2+CO2═Na2CO3+O2 | |
| B. | Na2CO3溶液呈碱性:CO32-+H2O?H2CO3+OH- | |
| C. | Na2CO3溶液除去CH3COOC2H5中的CH3COOH:CO32-+2H+═CO2↑+H2O | |
| D. | 饱和Na2CO3溶液处理水垢中的CaSO4:CO32-+CaSO4═CaCO3+SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮和硫及其化合物的转化是资源利用和环境保护的重要研究课题.
氮和硫及其化合物的转化是资源利用和环境保护的重要研究课题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com