
分析 由信息可知,该反应中氧化剂是NaIO3,还原剂是AsH3,I元素化合价变化为由+5价降低,As元素化合价变化为-3→+5价,
①根据碘元素化合价的降低情况来计算;根据原子守恒和得失电子守恒书写化学方程式;
②氧化剂的氧化性大于氧化产物,还原剂的还原性大于还原产物.
解答 解:①设X中碘元素的化合价为x,则0.4mol(5-x)=2mol,所以x=0,故X为I2,所以I元素化合价变化为由+5价降低到0价,As元素化合价变化为-3→+5价,由得失电子守恒和原子守恒,则化学方程式为:5AsH3+4H2SO4+8NaIO3=4Na2SO4+5H3AsO4+4I2+4H2O,
故答案为:I2;5AsH3+4H2SO4+8NaIO3=4Na2SO4+5H3AsO4+4I2+4H2O;
②在反应中,氧化剂为NaIO3,还原剂为AsH3,氧化产物为H3AsO4,还原产物为I2,
由氧化剂的氧化性大于氧化产物的氧化性可知NaIO3>H3AsO4,由还原剂的还原性大于还原产物的还原性可知AsH3>X (I2),
故答案为:ac.
点评 本题考查氧化还原反应,为高考常见题型,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念和转移电子的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ④⑤⑥⑦ | C. | ②⑥ | D. | ①②③④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.10 mol•L-1AgNO3溶液 | B. | 0.10 mol•L-1ZnSO4溶液 | ||
| C. | 0.20 mol•L-1CuCl2溶液 | D. | 0.20 mol•L-1Mg(NO3)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
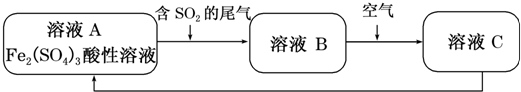
| A. | 向C溶液中滴加KSCN溶液,溶液变为血红色 | |
| B. | 溶液B转化为溶液C发生的变化的离子方程式为4H++2Fe2++O2═2Fe3++2H2O | |
| C. | 溶液酸性A>B>C | |
| D. | 加氧化亚铁可以使溶液C转化为溶液A |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
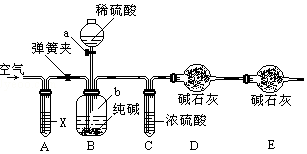 某纯碱样品中含有少量氯化钠杂质,现用如图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去).实验步骤如下:
某纯碱样品中含有少量氯化钠杂质,现用如图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去).实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.2gCH3OH含有的化学键数为0.4NA | |
| B. | 0.1molFeCl3水解制得的Fe(OH)3胶体中胶粒数是0.1NA | |
| C. | 标准状况下,2.24LCl2溶于足量水,转移的电子数为0.1NA | |
| D. | 0.2gD216O中含有的质子数、中子数和电子数均为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 离子 | 离子浓度(mol•L-1) | |
| 还原前 | 还原后 | |
| SO42- | 3.20 | 3.50 |
| Fe2+ | 0.15 | 3.30 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com