
【题目】下列图中的实验方案,能达到实验目的是( )
A | B | C | D | |
实验方案 |
|
|
|
|
实验目的 | 探究温度对平衡的影响 | 比较HCl、H2CO2和 | 除去CO2气体中混有的SO2 | 验证FeCl3对H2O2分解反应有催化作用 |
A.A
B.B
C.C
D.D
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符合的是( ) 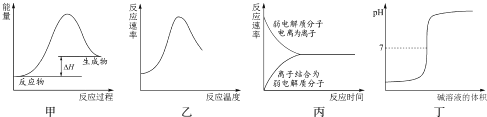
A.图甲表示燃料燃烧反应的能量变化
B.图乙表示酶催化反应的反应速率随反应温度的变化
C.图丙表示弱电解质在水中建立电离平衡的过程
D.图丁表示强碱滴定强酸的滴定曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把下列四种Na2S2O3溶液分别加入四只盛有10m L 2mol.L-1盐酸的烧杯中,其中反应速率最快的是( )
A. 10℃、20mL、2mol·L-1的Na2S2O3溶液B. 20℃、20mL、2mol·L-1的Na2S2O3溶液
C. 10℃、20mL、4mol·L-1的Na2S2O3溶液D. 20℃、20mL、4mol·L-1的Na2S2O3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同种物质中同一价态的元素部分被氧化,部分被还原的氧化还原反应是( )
A.3Br2+6KOH=5KBr+KBrO3+3H2O
B.MnO2+4HCl(浓) ![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
C.2KNO3 ![]() 2KNO2+O2↑
2KNO2+O2↑
D.NH4NO3 ![]() N2O↑+2H2O
N2O↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量的钠、钾投入一定量的稀盐酸中,产生气体随时间变化的曲线如图所示,则下列说法正确的是( )
A.投入的Na、K一定等质量
B.投入的Na的质量小于K的质量
C.曲线a为Na,b为K
D.稀盐酸的量一定是不足量的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是(NA表示阿伏伽德罗常数的值)( )
A.1mol N2中含有的电子数为2NA
B.标准状态下,22.4L水所含的氧原子数为NA
C.23g钠在化学反应中失去电子数目为10 NA
D.2g氢气所含的氢原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全世界每年被腐蚀损耗的钢铁材料约占全年钢铁产量的十分之一.研究钢铁的腐蚀及防护有重要意义.回答下列问题:
(1)钢铁发生腐蚀的主要类型是电化学腐蚀,在电化学腐蚀中,负极反应是 , 正极反应是 .
(2)某实验小组设计图1实验探究铁生锈的条件: 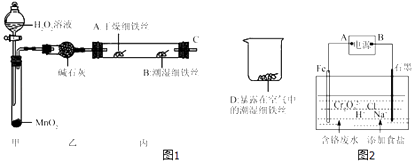
反应4min后观察,发现A处铁丝依然光亮,B处铁丝表面灰暗,D处铁丝依然光亮.该实验说明铁生锈主要与和有关;B、D处实验现象对比说明:决定铁生锈的一个重要因素是 .
(3)金属及塑料制品表面镀铬不仅美观还可提高金属制品抗腐蚀性能.常见镀铬液由重铬酸(H2Cr2O7)和催化剂硫酸组成.
①重铬酸中,Cr元素的化合价为 .
②镀铬时由CrO42﹣放电产生铬镀层.阴极的电极反应式为 .
(4)电镀废水中Cr2O72﹣具有高毒性,必须经处理后才能排放.电解法处理含铬的强酸性废水的原理如图2所示.
电解产生的Fe2+将Cr2O72﹣还原为Cr3+ , 再随着溶液pH的升高,便有Fe(OH)3和Cr(OH)3沉淀生成.
①图中A为电源极;电解时阴极产生的气体为(写化学式).
②写出Fe2+与Cr2O72﹣反应的离子方程式: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com