
【题目】汽车尾气中含有CO、NO、NO2、碳氢化合物等多种污染物。回答下列问题:
(1)汽车燃料中不含氮元素,尾气中所含NO产生的原因是__。
(2)已知:2C8H18(1)+25O2(g)=16CO2(g)+18H2O(g) △H1=-10244kJ·mol-1
N2(g)+O2(g)=2NO(g) △H2
2NO(g)+2CO(g)=N2(g)+2CO2(g) △H3=-746kJ·mol-1
①若H2O(1)=H2O(g) △H=+44kJ·mol-1,则表示辛烷燃烧热的热化学方程式为__。
②部分化学键键能数据如下:

△H2=___kJ·mol-1
(3)1573K时,N2+O2![]() 2NO平衡常数为2.0×10-6,若测得内燃机内平衡混合气中氮气、氧气的物质的量分别为0.2mol、0.001mol,则生成NO的物质的量为__mol,N2的转化率为__。
2NO平衡常数为2.0×10-6,若测得内燃机内平衡混合气中氮气、氧气的物质的量分别为0.2mol、0.001mol,则生成NO的物质的量为__mol,N2的转化率为__。
(4)反应NO(g)+CO(g)=N2(g)+CO2(g)的平衡常数为1.68×1060,从热力学角度看,该反应程度应该很大,实际汽车尾气中该反应的程度很小,原因是__,要增大汽车尾气净化装置中单位时间内该反应的程度,关键是要___。
【答案】高温下空气中的氮气与氧气反应产生的 C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l) ΔH=-5518kJ·mol-1 +196 2.0×10-5 0.005% 该反应活化能高,反应速率慢 寻找耐高温的催化剂
O2(g)=8CO2(g)+9H2O(l) ΔH=-5518kJ·mol-1 +196 2.0×10-5 0.005% 该反应活化能高,反应速率慢 寻找耐高温的催化剂
【解析】
此题借助汽车尾气转化过程,综合考查化学反应原理,考点涉及利用盖斯定律计算和书写热化学方程式,化学反应速率的影响因素,化学平衡及平衡常数的计算,考查学生的计算能力和分析能力。
(1)汽车燃料中不含氮元素,尾气中含NO,则N可能来源于空气,空气中的氮气与氧气在高温条件下发生反应得到NO;
(2)①已知I:2C8H18(1)+25O2(g)=16CO2(g)+18H2O(g) △H1=-10244kJ·mol-1
II:H2O(1)=H2O(g) △H4=+44kJ·mol-1
根据盖斯定律,将I÷2-II ×9得,C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l), ΔH=△H1÷2-△H4×9=(-10244÷2-44×9) kJ·mol-1=-5518kJ·mol-1,即辛烷燃烧热的热化学方程式为C8H18(l)+
O2(g)=8CO2(g)+9H2O(l), ΔH=△H1÷2-△H4×9=(-10244÷2-44×9) kJ·mol-1=-5518kJ·mol-1,即辛烷燃烧热的热化学方程式为C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l) ΔH=-5518kJ·mol-1;
O2(g)=8CO2(g)+9H2O(l) ΔH=-5518kJ·mol-1;
②根据表格所给数据以及已知方程,将N2(g)+O2(g)=2NO(g) △H2
2NO(g)+2CO(g)=N2(g)+2CO2(g) △H3=-746kJ·mol-1
将两热化学方程式相加,得到新的热化学方程式为2CO(g) +O2(g) = 2CO2(g) ΔH=△H2+△H3=(2×1076+494-4×799) kJ·mol-1=-550 kJ·mol-1,△H2=ΔH-△H3=[-550-(-746)] kJ·mol-1=+196 kJ·mol-1;
(3)设内燃机体积为V,则K=c2(NO)÷[c(N2)c(O2)]= n2(NO)÷[n(N2)n(O2)]= 2.0×10-6,代入数据算出n(NO)= 2.0×10-5 mol,则转化的N2的物质的量为1.0×10-5 mol,N2的转化率=1.0×10-5 mol÷(1.0×10-5 mol+0.2mol)×100%=0.005%;
(4)平衡常数很大,反应程度应该很大,实际汽车尾气中该反应的程度很小,可能是因为该反应活化能高,反应速率慢,要增大汽车尾气净化装置中单位时间内该反应的程度,即增加净化速率,需要降低活化能,需要寻找耐高温的催化剂。


科目:高中化学 来源: 题型:
【题目】水中的溶解氧是水生生物生存不可缺少的条件。某课外小组设计如图所示的实验装置![]() 夹持装置略
夹持装置略![]() ,采用碘量法测定学校周边河水中的溶解氧的含量。
,采用碘量法测定学校周边河水中的溶解氧的含量。
实验步骤及测定原理如下:

Ⅰ.取样、氧的固定
![]() 用溶解氧瓶采集水样,记录大气压及水体温度。
用溶解氧瓶采集水样,记录大气压及水体温度。
![]() 向烧瓶中加入200mL水样。
向烧瓶中加入200mL水样。
![]() 向烧瓶中依次迅速加入
向烧瓶中依次迅速加入![]() 无氧溶液
无氧溶液![]() 过量
过量![]() 和2mL碱性KI无氧溶液
和2mL碱性KI无氧溶液![]() 过量
过量![]() ,开启搅拌器,反应生成
,开启搅拌器,反应生成![]() ,实现氧的固定。
,实现氧的固定。
Ⅱ![]() 酸化、滴定
酸化、滴定
![]() 搅拌,并向烧瓶中加入2mL硫酸无氧溶液至
搅拌,并向烧瓶中加入2mL硫酸无氧溶液至![]() 被
被![]() 还原为
还原为![]() ,溶液为中性或弱酸性。
,溶液为中性或弱酸性。
![]() 在暗处静置5min后,取一定量溶液,用
在暗处静置5min后,取一定量溶液,用![]() 标准溶液滴定生成的
标准溶液滴定生成的![]() ,记录数据。
,记录数据。
![]()
![]() 处理数据
处理数据![]() 忽略氧气从水样中的逸出量和加入试剂后水样体积的变化
忽略氧气从水样中的逸出量和加入试剂后水样体积的变化![]() 。
。
回答下列问题:
![]() 配制以上无氧溶液时,除去所用溶剂水中的氧气的简单操作为________。
配制以上无氧溶液时,除去所用溶剂水中的氧气的简单操作为________。
![]() 取水样时应尽量避免扰动水体表面,这样操作的主要目的是________。
取水样时应尽量避免扰动水体表面,这样操作的主要目的是________。
![]() “步骤c”中“搅拌”的作用是________。
“步骤c”中“搅拌”的作用是________。
![]() “氧的固定”中发生主要反应的化学方程式为________。
“氧的固定”中发生主要反应的化学方程式为________。
![]() “步骤f”为________。
“步骤f”为________。
![]() “步骤e”中,用amol/LNa2S2O3标准溶液滴定,以淀粉溶液作指示剂,滴定终点的现象为________;若200mL水样经处理后,共消耗
“步骤e”中,用amol/LNa2S2O3标准溶液滴定,以淀粉溶液作指示剂,滴定终点的现象为________;若200mL水样经处理后,共消耗![]() 标准溶液的体积为bmL,则水样中溶解氧的含量为________
标准溶液的体积为bmL,则水样中溶解氧的含量为________![]() 用含字母的式子表示)mg/L。
用含字母的式子表示)mg/L。
![]() “步骤d”中加入硫酸溶液反应后,若溶液pH过低,滴定时会产生明显的误差,写出产生此误差的原因
“步骤d”中加入硫酸溶液反应后,若溶液pH过低,滴定时会产生明显的误差,写出产生此误差的原因![]() 用离子方程式表示,至少写出2个
用离子方程式表示,至少写出2个![]() :________。
:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
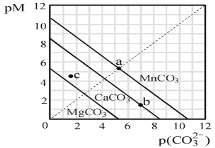
已知pM=-lgc(M),p(CO![]() )=-lgc(CO
)=-lgc(CO![]() )。
)。
A.MgCO3、CaCO3、MnCO3的Ksp依次增大
B.a点可表示MnCO3的饱和溶液,且c(Mn2+)=c(CO![]() )
)
C.b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO![]() )
)
D.c点可表示MgCO3的过饱和溶液,且c(Mg2+)<c(CO![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题
(1)立方烷 ![]() 的六氯代物有_________种。
的六氯代物有_________种。
(2)甲基的电子式 ________________________。
(3)![]() 的系统命名________________________________________。
的系统命名________________________________________。
(4)下列物质的沸点按由高到低的顺序排列的是______________。
①CH3(CH2)2CH3 ②CH3(CH2)3CH3 ③ (CH3)3CH ④ (CH3)2CHCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组反应中,属于可逆反应的一组是( )
A. 2H2O![]() 2H2↑+O2↑,2H2+O2
2H2↑+O2↑,2H2+O2![]() 2H2O
2H2O
B. NH3+CO2+H2O=NH4HCO3,NH4HCO3![]() NH3↑+H2O↑+CO2↑
NH3↑+H2O↑+CO2↑
C. H2+I2![]() 2HI,2HI
2HI,2HI![]() H2↑+I2↑
H2↑+I2↑
D. 2Ag+Br2![]() 2AgBr,2AgBr
2AgBr,2AgBr![]() 2Ag+Br2
2Ag+Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫酸厂用以下几种方法处理SO2尾气。
(1)活性炭还原法
反应原理:恒温恒容2C(s)+2SO2(g)![]() S2(g)+2CO2(g)。
S2(g)+2CO2(g)。
反应进行到不同时间测得各物质的浓度如图:

①第一次出现平衡的时间是第__min;
②0~20min反应速率表示为v(SO2)=__;
③30min时,改变某一条件平衡移动,则改变的条件最有可能是__;40min时,平衡常数值为__。
(2)亚硫酸钠吸收法
常温下,Na2SO3溶液吸收SO2生成NaHSO3,当吸收至pH=6时,吸收液中相关离子浓度关系一定正确的是__(填序号)。
a.c(Na+)+c(H+)>c(SO![]() )+c(HSO
)+c(HSO![]() )+c(OH-)
)+c(OH-)
b.c(Na+)=c(SO![]() )+c(HSO
)+c(HSO![]() )+c(H2SO3)
)+c(H2SO3)
c.水电离出的c(OH-)=1×10-8mol·L-1
d.c(Na+)>c(SO![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
(3)电化学处理法
如图所示,Pt(1)电极的反应式为__;碱性条件下,用Pt(2)电极排出的S2O![]() 溶液吸收NO2,使其转化为N2,同时有SO
溶液吸收NO2,使其转化为N2,同时有SO![]() 生成。若阳极转移电子6mol,则理论上处理NO2气体__g。
生成。若阳极转移电子6mol,则理论上处理NO2气体__g。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有甲、乙、丙、丁、戊5种物质,在一定条件下,它们能按下图方式进行转化:

其推断正确的是
选项 | 甲 | 乙 | 丙 | 丁 | 戊 |
A | NH3 | O2 | NO | H2O | NO2 |
B | Mg | CO2 | C | MgO | CO |
C | C | H2O | CO | H2 | HCOOH |
D | FeBr2 | Cl2 | FeCl2 | Br2 | FeCl3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,浓度都是1mol·L-1的两种气体X2和Y2在密闭容器中反应,经过tmin后,测得物质的浓度分别为:c(X2)=0.4mol·L-1,c(Y2)=0.8mol·L-1,则该反应的方程式可表示为()
A. X2+2Y2![]() 2XY2B. 2X2+Y2
2XY2B. 2X2+Y2![]() 2X2Y
2X2Y
C. X2+3Y2![]() 2XY3D. 3X2+Y2
2XY3D. 3X2+Y2![]() 2X3Y
2X3Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的若干种,现取X溶液进行连续实验,实验过程及产物如下:
中的若干种,现取X溶液进行连续实验,实验过程及产物如下:
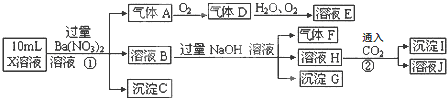
下列说法正确的是
A.气体F不能与溶液E发生反应
B.X中肯定存在![]() 、
、![]() 、
、![]() 、
、![]()
C.X中肯定不存在![]() 、
、![]() 、
、![]()
D.X中不能确定的离子是![]() 和
和![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com