
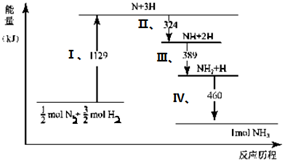
| A. | Ⅰ中1129 kJ为该反应过程的活化能 | |
| B. | N2(g)+3H2 (g)?2NH3 (g)△H=2(324+389+460-1129)kJ/mol | |
| C. | Ⅱ、Ⅲ、Ⅳ均为放热过程 | |
| D. | N2(g)+3H2 (g)?2NH3 (g)△H>0 |
分析 A.活化能一种物质分子由普通分子进化为活化分子所需能量;
B.图象分析反应的焓变=生成物能量-反应物能量=断裂化学键吸收的能量-形成化学键放出的能量计算;
C.图中Ⅱ、Ⅲ、Ⅳ三个过程均是能量降低,所以是放热过程;
D.由图可知最终反应物的能量高于生成物的能量,是放热反应,△H>0为吸热反应.
解答 解:A.Ⅰ中1129 kJ为该反应正反应的活化能,逆反应的活化能为(324+389+460)KJ,该反应过程的活化能1129 kJ-(324+389+460)KJ,故A错误;
B.由图可知N2(g)+3H2 (g)?2NH3 (g)△H=2[1129-(324+389+460-)]kJ/mol,故B错误;
C.Ⅰ为共价键的断裂吸热、Ⅱ、Ⅲ、Ⅳ为共价键的形成,图象中Ⅱ、Ⅲ、Ⅳ三个过程均是能量降低的变化,所以是放热过程,故C正确;
D.由图可知最终反应物的能量高于生成物的能量,是放热反应,N2(g)+3H2 (g)?2NH3 (g)△H<0,故D错误;
故选C.
点评 本题考查了化学反应能量变化,图象分析判断,注意拆化学键吸收能量,形成化学键放出能量,掌握基础是解题关键,题目难度中等.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 FeCl3溶液:K+、NH4+、I-、SO42- | |
| B. | 使酚酞变红色的溶液:Na+、Al3+、NO3-、Cl- | |
| C. | 0.1 mol•L-1 NH4HCO3溶液:K+、Na+、NO3-、Cl- | |
| D. | 由水电离的c(H+)=1×10-13 mol•L-1的溶液:Mg2+、Ca2+、NO3-、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
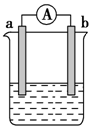 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
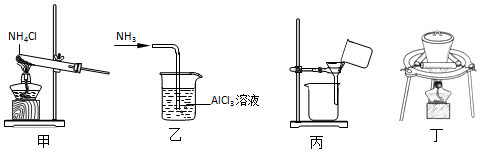
| A. | 用装置甲制取NH3 | B. | 用装置乙制备Al(OH)3 | ||
| C. | 用装置丙进行过滤操作 | D. | 用装置丁灼烧Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
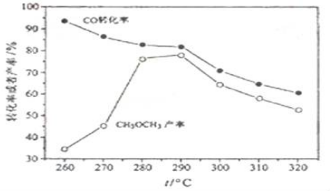 二甲醚(CH3OCH3)是无色气体,可作为一种新型能源,由合成气(组成为H2、CO、少量CO2)直接制备二甲醚,其中主要过程包括以下四个反应:
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源,由合成气(组成为H2、CO、少量CO2)直接制备二甲醚,其中主要过程包括以下四个反应:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
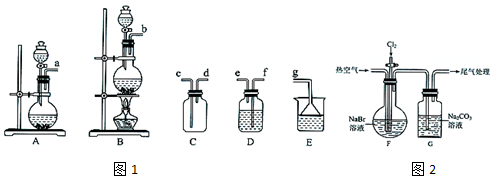
| 操作步骤 | 实验现象 | 结论或解释 |
| ①去适量G中溶液于试管中,加入硫酸酸化 | 产生气泡 | G中溶液含有CO32-或HCO3- |
| 向①的试管中加入CCl4,振荡,静置 | ②溶液分层,下层为棕红色 | 生成单质溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com