
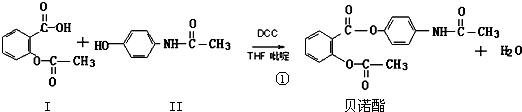
 ,反应④的反应类型为取代反应.
,反应④的反应类型为取代反应.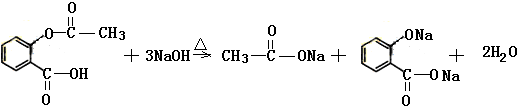 .
.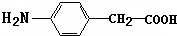 .
.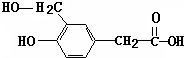 在
在 催化作用下也能与扑热息痛(Ⅱ)发生类似①的反应,产物的结构简式为:
催化作用下也能与扑热息痛(Ⅱ)发生类似①的反应,产物的结构简式为: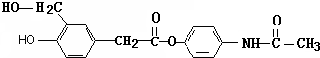 .
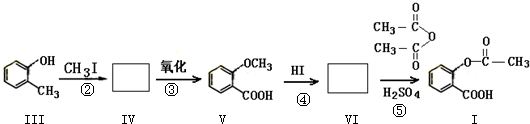
. 分析 根据题中的各物质相互转化关系,比较Ⅲ和Ⅴ的结构简式及步骤②③的条件可知,Ⅲ发生取代反应得Ⅳ,Ⅳ发生氧化反应得Ⅴ,所以Ⅳ为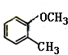 ,比较Ⅴ和Ⅰ的结构可知,Ⅴ发生取代反应得Ⅵ,Ⅵ发生取代反应得Ⅰ,所以Ⅵ为
,比较Ⅴ和Ⅰ的结构可知,Ⅴ发生取代反应得Ⅵ,Ⅵ发生取代反应得Ⅰ,所以Ⅵ为 ,
,
(1)根据化合物V的结构简式可知其中所含氧官能团名称;
(2)根据上面的分析可知VI的结构简式和反应④的类型;
(3)酚羟基容易被氧化;
(4)化合物I在碱性条件下可以发生完全水解;
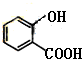
(5)根据条件①苯环上仅有两个处于对位的官能团,②能与NaHCO3溶液反应放出无色气体,说明分子中有羧基,据此写出Ⅱ的同分异构体;
(6)根据题中信息,反应①是化合物Ⅰ中的羧基与化合物Ⅱ中的酚Ⅱ羟基发生酯化反应,据此可类似推出 在
在 催化作用下与扑热息痛(Ⅱ)反应的产物的结构简式.
催化作用下与扑热息痛(Ⅱ)反应的产物的结构简式.
解答 解:根据题中的各物质相互转化关系,比较Ⅲ和Ⅴ的结构简式及步骤②③的条件可知,Ⅲ发生取代反应得Ⅳ,Ⅳ发生氧化反应得Ⅴ,所以Ⅳ为 ,比较Ⅴ和Ⅰ的结构可知,Ⅴ发生取代反应得Ⅵ,Ⅵ发生取代反应得Ⅰ,所以Ⅵ为
,比较Ⅴ和Ⅰ的结构可知,Ⅴ发生取代反应得Ⅵ,Ⅵ发生取代反应得Ⅰ,所以Ⅵ为 ,
,
(1)根据化合物V的结构简式可知其中所含氧官能团名称为醚键、羧基,故答案为:醚键、羧基;
(2)根据上面的分析可知VI的结构简式为 ,反应④的类型为取代反应,故答案为:
,反应④的类型为取代反应,故答案为: ;取代反应;
;取代反应;
(3)由于酚羟基容易被氧化,所以反应②和反应④的作用是防止氧化侧链甲基时酚羟基被氧化,
故答案为:防止氧化侧链甲基时酚羟基被氧化;
(4)化合物I在碱性条件下可以发生完全水解,反应的化学方程式为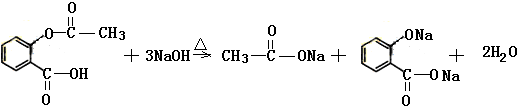 ,
,
故答案为: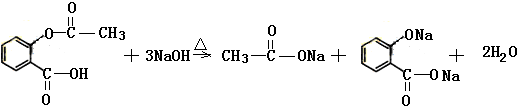 ;
;
(5)根据条件①苯环上仅有两个处于对位的官能团,②能与NaHCO3溶液反应放出无色气体,说明分子中有羧基,据此写出Ⅱ的同分异构体为 ,
,
故答案为: ;
;
(6)根据题中信息,反应①是化合物Ⅰ中的羧基与化合物Ⅱ中的酚Ⅱ羟基发生酯化反应,据此可类似推出 在
在 催化作用下与扑热息痛(Ⅱ)反应的产物的结构简式为
催化作用下与扑热息痛(Ⅱ)反应的产物的结构简式为 ,
,
故答案为: .
.
点评 本题考查有机物推断,注意充分利用有机物结构简式与分子式、转化条件进行推断,需要学生熟练掌握官能团的性质,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
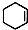 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

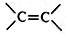 );下列试剂能与甲反应而褪色的是ac(填标号)
);下列试剂能与甲反应而褪色的是ac(填标号) +RCl$\stackrel{AlCl_{3}}{→}$
+RCl$\stackrel{AlCl_{3}}{→}$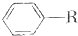 +HCl(-R为烃基)
+HCl(-R为烃基)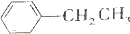 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$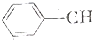 =CH2+H2
=CH2+H2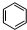 +CH3CH2Cl$→_{△}^{AlCl_{3}}$
+CH3CH2Cl$→_{△}^{AlCl_{3}}$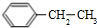 +HCl
+HCl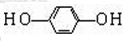 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 molKClO3 | B. | 22.4LHCl气体 | C. | 2 molNaCl | D. | 1 mol AlCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 0.01mol•L-1KIO3酸性溶液(含淀粉)的体积/mL | 0.01mol•L-1 Na2SO3溶液的体积/mL | H2O的体 积/mL | 实验温 度/℃ | 溶液出现蓝色时所需时间/s | |
| 实验1 | 5 | V1 | 35 | 25 | t 1 |
| 实验2 | 5 | 5 | 40 | 25 | t 2 |
| 实验3 | 5 | 5 | V2 | 0 | t 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com