
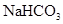 晶体中阳离子和阴离子总数为0.03NA ⑥3.9gNa2O2吸收足量的CO2时转移的电子数是0.05NA ⑦标准状况下,3.2g铜与足量的浓硝酸反应生成的气体含有的分子数是0.1NA
晶体中阳离子和阴离子总数为0.03NA ⑥3.9gNa2O2吸收足量的CO2时转移的电子数是0.05NA ⑦标准状况下,3.2g铜与足量的浓硝酸反应生成的气体含有的分子数是0.1NA | A.①②④ | B.④⑥ | C.③④⑤ | D.④⑥⑦ |
 Cu2S,所以1mol铜与足量硫蒸气反应,转移电子数为NA。错误。 ④用惰性电极电解CuCl2溶液,反应方程式为:CuCl2
Cu2S,所以1mol铜与足量硫蒸气反应,转移电子数为NA。错误。 ④用惰性电极电解CuCl2溶液,反应方程式为:CuCl2 Cu+Cl2.↑由方程式可看出,若转移电子2 NA,阴极析出铜1mol,即64g,。现在,线路中通过的电子数为NA,所以产生Cu32g.正确。 ⑤NaHCO3=Na++HCO3-。每摩尔的盐中含有2 NA个离子。n(NaHCO3)="m/M=0.84" g÷84g/mol=0.01mol.故晶体中阳离子和阴离子总数为0.02NA。错误。 ⑥Na2O2和CO2反应的方程式为:2Na2O2+2CO2= Na2CO3+O2.每摩尔的Na2O2反应,转移电子1mol.n(Na2O2)=" m/M=3.9g÷78g/mol=0.05mol" .所以转移的电子数是0.05NA 正确。⑦铜与足量的浓硝酸反应的方程式为:Cu+4HNO3(浓)= Cu(NO3)2+ 2NO2↑+2H2O. 2NO2
Cu+Cl2.↑由方程式可看出,若转移电子2 NA,阴极析出铜1mol,即64g,。现在,线路中通过的电子数为NA,所以产生Cu32g.正确。 ⑤NaHCO3=Na++HCO3-。每摩尔的盐中含有2 NA个离子。n(NaHCO3)="m/M=0.84" g÷84g/mol=0.01mol.故晶体中阳离子和阴离子总数为0.02NA。错误。 ⑥Na2O2和CO2反应的方程式为:2Na2O2+2CO2= Na2CO3+O2.每摩尔的Na2O2反应,转移电子1mol.n(Na2O2)=" m/M=3.9g÷78g/mol=0.05mol" .所以转移的电子数是0.05NA 正确。⑦铜与足量的浓硝酸反应的方程式为:Cu+4HNO3(浓)= Cu(NO3)2+ 2NO2↑+2H2O. 2NO2 N2O4.n(Cu) ="m/M=3.2g÷64g/mol=0.05mol" .3.2g铜与足量的浓硝酸反应生成的气体含有的分子数少于0.1NA。错误。
N2O4.n(Cu) ="m/M=3.2g÷64g/mol=0.05mol" .3.2g铜与足量的浓硝酸反应生成的气体含有的分子数少于0.1NA。错误。

科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.18g D2O含有电子数为10 NA |
| B.NA个Fe(OH)3胶体粒子的质量为107 g |
| C.12g石墨中含有的σ键数目为3NA |
| D.常温常压下,S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2 NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.5.6g铁粉与足量Cl2反应,失去的电子数为0.2NA |
| B.1mol NH3含有的电子数10NA |
| C.常温常压下,22.4 L的氧气含氧原子数为2NA |
| D.常温下,1 L0.1mol·L-1AlCl3溶液中含Al3+数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.若金属没有剩余,反应中转移的电子数目为2y NA |
| B.若金属全部溶解,则溶液中一定含有Fe3+ |
| C.当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80 y(1-a/3) |
| D.若金属全部溶解,且产生336 mL气体(标准状况),则b=0.3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2.24 L CO2中含有的原子数为0.3×6.02×1023 |
| B.1.8 g NH4+ 含有的质子数为6.02×1023 |
| C.30 g乙酸和甲酸甲酯的混合物中含有的共价键数为4×6.02×1023 |
| D.7.8 g Na2O2中含有的阴离子数为0.2×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.标准状况下, 22.4 L H2O含有分子数为NA |
| B.分子总数为NA的N2、CO混合气体体积约为22.4 L,质量为28 g |
| C.常温常压下,1.6 g CH4含原子数为0.5NA |
| D.足量的CO2与39 g Na2O2发生反应,转移的电子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com