
分析 同温同压下,同体积的气体具有相同的分子数,则具有相同的物质的量,再利用构成来分析原子数,利用m=n×M来分析质量,由pM=ρRT可知,密度之比等于摩尔质量之比.
解答 解:因同温同压下,同体积的气体具有相同的分子数,则具有相同的物质的量,
则N2和SO2分子数之比为1:1,物质的量之比为1:1,
原子总数之比为1×2:1×3=2:3,
摩尔质量之比为28g/mol:64g/mol=7:16,
质量之比为1×7:1×16=7:16,
又由pM=ρRT可知,同温同压下气体的密度之比等于摩尔质量之比,
则密度之比为7:16,
故答案为:1:1;2:3;7:16;7:16.
点评 本题考查阿伏伽德罗定律及其推论,明确相同温度和压强下气体的体积与物质的量的关系及物质的构成即可解答,并应熟悉常见气体的摩尔质量来解答.


科目:高中化学 来源: 题型:填空题
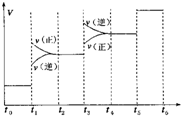 氢气是一种新型的绿色能源,又是一种重要的化工原料.
氢气是一种新型的绿色能源,又是一种重要的化工原料.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 2SO2(g)+O2(g)?2SO3(g);△H<0 | B. | 4NH3(g)+O2(g)?4NO(g)+6H2O (g);△H<0 | ||
| C. | H2(g)+I2(g)?2HI (g);△H>0 | D. | C (s)+H2O (g)?CO (g)+H2 (g);△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯和乙烯都能使溴水褪色,且反应原理相同 | |
| B. | 乙炔和苯均为不饱和烃,都只能发生加成反应 | |
| C. | 分子式为C10H14 苯环上只有一个取代基的芳香烃,其可能的结构有3种 | |
| D. | 乙烯和氯乙烯都可以通过聚合反应得到高分子材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤ | B. | ②⑤ | C. | ①②④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强碱性溶液:Mg2+、NH4+、Cl-、NO3- | |
| B. | 使甲基橙变红的溶液:Na+、Fe3+、Cl-、S2O32- | |
| C. | 无色溶液中:K+、Al3+、HCO3-、Cr2O72- | |
| D. | 常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、Na+、AlO2-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题




查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com