
【题目】已知室温时,0.1 mol·L-1某一元酸HA在水中有0.1%发生电离,下列叙述错误的是
A. 该溶液的pH=4
B. 升高温度,溶液的pH增大
C. 此酸的电离常数约为1×10-7
D. 稀释HA溶液时,不是所有粒子浓度都一定会减小
科目:高中化学 来源: 题型:
【题目】银锌蓄电池应用广泛,放电时总反应为Zn+Ag2O2+H2O==Zn(OH)2+Ag2O,某小组以银锌蓄电池为电源,用惰性电极电解饱和Na2SO4溶液制备H2SO4和NaOH,设计如图所示装置。连通电路后,下列说法正确是
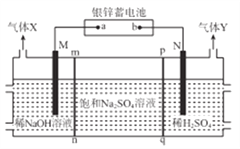
A. 电池的a极反应式为Ag2O2+H2O+2e-=Ag2O+2OH-
B. 气体Y为H2
C. pq膜适宜选择阳离子交换膜
D. 电池中消耗65gZn,理论上生成1mol气体X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了检验淀粉水解产物,某学生设计了如下实验方案:
淀粉液![]() 水解液
水解液![]() 混合液
混合液![]() 砖红色沉淀
砖红色沉淀
回答下列问题:
试剂2是_____________,作用是___________________;如果实验过程中没有加入试剂2而直接加入试剂3,能否实现实验目的______________,若不能,其原因是_________________,最简单的改正措施是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为原电池装置示意图。
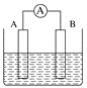
(1)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,作负极的分别是_____(填字母)。
A.铝片、铜片 B.铜片、铝片
C.铝片、铝片 D.铜片、铜片
写出插入烧碱溶液中形成的原电池的负极反应式____
(2)若A为Pb,B为PbO2,电解质为H2SO4溶液,工作时的总反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O。写出B电极反应式___,该电池在工作时,A电极的质量将___(填“增加”“减小”或“不变”)。若该电池反应消耗了0.1 mol H2SO4,则转移电子的数目为___。
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为氢氧燃料电池,写出A电极反应式:_____;该电池在工作一段时间后,溶液的碱性将_____(填“增强”“减弱”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石棉尾矿主要含有Mg3(Si2O5)(OH)4和少量的Fe2O3、Al2O3。以石棉尾矿为镁源制备碳酸镁晶体(MgCO3·nH2O)的工艺如下:
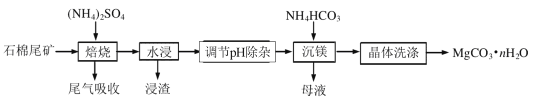
已知“焙烧”过程中的主反应为:
![]()
(1)写出焙烧产物NH3的电子式_____________________。
(2)为提高水浸速率,可采取的措施为_______________________(任写一条),“浸渣”的主要成分为__________________。
(3)“调节pH除杂”时,需将pH调至5.0,则除去的杂质离子是______________,此时溶液中的c(Fe3+)=__________________(已知Ksp[Fe(OH)3]=4.0×10-38)。
(4) “沉镁”过程中反应的离子方程式为_______________________________________。“沉镁”时若温度超过60℃,将产生较多的碱式碳酸镁杂质,原因是________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下的水溶液中离子浓度曲线如图所示,下列说法不正确的是
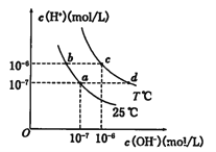
A. 向b点对应的醋酸溶液中滴加NaOH溶液至a点,此时c(Na+)=c(CH3COO-)
B. 25℃时,加入CH3COONa可能引起由c向d的变化,升温可能引起a向c的变化
C. T℃时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性
D. b点对应的溶液中大量存在:K+、Ba2+、NO3-、I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A. 往碳酸镁中滴加稀盐酸:CO![]() + 2H
+ 2H![]() = CO2↑+ H2O
= CO2↑+ H2O
B. 用小苏打治疗胃酸过多:HCO![]() + H
+ H![]() = CO2↑+ H2O
= CO2↑+ H2O
C. 盐酸滴入氨水中:H![]() + OH
+ OH![]() = H2O
= H2O
D. 锌溶解于稀硝酸中:Zn+ 2H![]() =Zn2++ H2↑
=Zn2++ H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 有相同容积的定容密封容器甲和乙,甲中加入
有相同容积的定容密封容器甲和乙,甲中加入![]() 和
和![]() 各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
A.甲、乙提高相同温度 B. 甲中加入0.1mol He,乙不改变
C.甲降低温度,乙不变 D. 甲增加0.1mol ![]() ,乙增加0.1mol I2
,乙增加0.1mol I2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com