
| A. | 质子数一定不等 | B. | 中子数一定不等 | ||
| C. | 质量数一定不等 | D. | 核外电子数一定不等 |
分析 根据元素的种类由质子数来决定,则不同元素的原子或离子质子数一定不同,中子数可能相同,也可能不同,再根据质量数=质子数+中子数,可知质量数可能相同,也可能不同;
由原子中核外电子数=核内质子数,阳离子中核外电子数=核内质子数-电荷数,阴离子中核外电子数=核内质子数+电荷数可知电子数可能相同,也可能不同.
解答 解:元素的种类由质子数来决定,则不同元素的原子或离子质子数一定不同,中子数可能相同,也可能不同,如136C和147N,126C和147N;
再根据质量数=质子数+中子数,可知质量数可能相同,也可能不同,如136C和147N,146C和147N;
由原子中核外电子数=核内质子数,阳离子中核外电子数=核内质子数-电荷数,阴离子中核外电子数=核内质子数+电荷数,可知电子数可能相同,也可能不同,如Na+和Mg2+、Na和Mg,
所以不同元素的原子或离子,一定具有不同的质子数,
故选:A.
点评 本题考查学生对元素的种类由质子数决定以及各微粒之间的关系,难度不大,注意举例说明.


科目:高中化学 来源: 题型:选择题
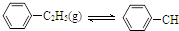 =CH2(g)+H2(g)△H=a kJ•mol-1下列说法正确的是( )
=CH2(g)+H2(g)△H=a kJ•mol-1下列说法正确的是( )| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
| n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
| A. | 保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率大于50% | |
| B. | 反应在前20 min的平均速率为v(H2)=0.004mol•L-1•min-1 | |
| C. | 保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08mol•L-1,则a<0 | |
| D. | 相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2,达到平衡前v(正)>v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 方案 | 实验步骤 | 实验现象 | 结论 | 有关反应的化学方程式 |
| 1 | 取少量待测溶液,向其中滴加适量BaCl2溶液 | |||
| 2 | 猜想②正确 | 无 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由极性键构成的极性分子 | B. | 由极性键构成的非极性分子 | ||
| C. | 由非极性键构成的极性分子 | D. | BeCl2中Be采取sp2杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由非电解质溶于水得到的溶液 | |
| B. | c(H+)、c(OH-)均为5.0×10-7mol•L-1的溶液 | |
| C. | 等物质的量的强酸与强碱反应得到的溶液 | |
| D. | 将pH=9的烧碱溶液稀释100倍所得到的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是放热反应的发生均无需加热 | |
| B. | 凡是需要加热后才能发生的反应一定是吸热反应 | |
| C. | 伴有能量变化的物质变化都是化学变化 | |
| D. | 物质发生化学反应都伴随着能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y形成化合物时,X可以显负价,Y显正价 | |
| B. | 气态氢化物的稳定性:HmY小于HnX | |
| C. | 第一电离能可能Y小于X | |
| D. | 最高价含氧酸的酸性:X对应的酸的酸性弱于Y对应的酸的酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如下变化:
X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如下变化:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com