
分析 (1)由方程式可知△c(B)=2△c(A),2min末B的浓度=B的起始浓度-△c(B);
(2)根据v=$\frac{△c}{△t}$计算v(A).
解答 解:(1)△c(A)=1.0mol/L-0.8mol/L=0.2mol/L,由A+2B═3C,可知△c(B)=2△c(A)=0.4mol/L,故2min末B的浓度=1.2mol/L-0.4mol/L=0.8mol/L,
答:2min末B的浓度为0.8mol/L.
(2)2min内△c(A)=0.2mol/L,则v(A)=$\frac{0.2mol/L}{2min}$=0.1mol/(L.min),
答:2min内用A物质的浓度变化来表示该反应的反应速率为0.1mol/(L.min).
点评 本题考查化学平衡计算、化学反应速率计算,比较基础,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | 根据溶液中的金属离子和残留固体的成分最多会有6种情况 | |
| B. | 若金属有剩余,在溶液中再滴入稀硫酸后,金属不会再溶解 | |
| C. | 当合金刚好溶解时,在标准状况下产生2.24LNO | |
| D. | 若合金全部溶解,在溶液中加入过量的氨水,经过滤、洗涤、干燥、充分灼烧、称量得固体5.35g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
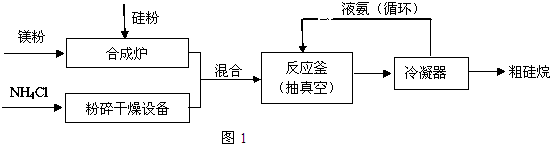
 .
. (2)三硅酸镁(Mg2Si3O8?nH2O)难溶于水,在医药上可做抗酸剂.它除了可以中和胃液中多余酸之外,生成的H2SiO3还可覆盖在有溃疡的胃表面,保护其不再受刺激.三硅酸镁与盐酸反应的化学方程式为Mg2Si3O8?nH2O+4HCl═2MgCl2+3H2SiO3+(n-1)H2O.
(2)三硅酸镁(Mg2Si3O8?nH2O)难溶于水,在医药上可做抗酸剂.它除了可以中和胃液中多余酸之外,生成的H2SiO3还可覆盖在有溃疡的胃表面,保护其不再受刺激.三硅酸镁与盐酸反应的化学方程式为Mg2Si3O8?nH2O+4HCl═2MgCl2+3H2SiO3+(n-1)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 甲 | 乙 | 丙 |
| ① | CO2 | SO2 | 石灰水 |
| ② | HCI | CO2 | 石灰水 |
| ③ | NO2 | SO2 | BaCI2 |
| ④ | CO2 | NH3 | CaCI2 |
| A. | ②④ | B. | ① | C. | ①③ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.00mol | B. | 0.500mol | C. | 0.275mol | D. | 0.250mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com