
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 将0.1molCl2通入一定量水中,HClO、Cl-、ClO-粒子数之和为0.2NA
B. 12gNaHSO4固体中含阳离子数为0.1NA
C. 将1molFe(OH)3加入到含3molHI的溶液完全反应后,溶液中所含I- 的数目为3NA
D. 已知合成氨反应N2(g)+3H2(g) ![]() 2NH3(g) △H= —92.4 kJ·mol-1,当该反应生成NA个NH3分子时,反应放出的热量大于46.2kJ
2NH3(g) △H= —92.4 kJ·mol-1,当该反应生成NA个NH3分子时,反应放出的热量大于46.2kJ
【答案】B
【解析】A. 氯水中存在平衡关系:Cl2+H2O![]() H++Cl-+HClO,将0.1molCl2通入一定量水中,HClO、Cl-、ClO-粒子数之和小于0.2NA,A错误;B. NaHSO4是由钠离子和硫酸氢根离子构成的离子化合物,12gNaHSO4是0.1mol,固体中含阳离子数为0.1NA,B正确;C. 将1molFe(OH)3加入到含3molHI的溶液中发生氧化还原反应生成亚铁离子和碘单质,完全反应后碘离子过量,所以根据电子得失守恒可知溶液中所含I- 的数目为2NA,C错误;D. 已知合成氨反应N2(g)+3H2(g)
H++Cl-+HClO,将0.1molCl2通入一定量水中,HClO、Cl-、ClO-粒子数之和小于0.2NA,A错误;B. NaHSO4是由钠离子和硫酸氢根离子构成的离子化合物,12gNaHSO4是0.1mol,固体中含阳离子数为0.1NA,B正确;C. 将1molFe(OH)3加入到含3molHI的溶液中发生氧化还原反应生成亚铁离子和碘单质,完全反应后碘离子过量,所以根据电子得失守恒可知溶液中所含I- 的数目为2NA,C错误;D. 已知合成氨反应N2(g)+3H2(g)![]() 2NH3(g) △H= —92.4 kJ·mol-1,当该反应生成NA个NH3分子即1mol氨气时,反应放出的热量为92.4 kJ·mol-1×0.5mol=46.2kJ,D错误,答案选B。
2NH3(g) △H= —92.4 kJ·mol-1,当该反应生成NA个NH3分子即1mol氨气时,反应放出的热量为92.4 kJ·mol-1×0.5mol=46.2kJ,D错误,答案选B。


科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①CH4(g)+2O2(g)![]() CO2(g)+2H2O(l) ΔH=890 kJ·mol1
CO2(g)+2H2O(l) ΔH=890 kJ·mol1
②2C2H6(g)+7O2(g)![]() 4CO2(g)+6H2O(l) ΔH=3116.7 kJ·mol1
4CO2(g)+6H2O(l) ΔH=3116.7 kJ·mol1
③C2H4(g)+3O2(g)![]() 2CO2(g)+2H2O(l) ΔH=1409.6 kJ·mol1
2CO2(g)+2H2O(l) ΔH=1409.6 kJ·mol1
④2C2H2(g)+5O2(g)![]() 4CO2(g)+2H2O(l) ΔH=2596.7 kJ·mol1
4CO2(g)+2H2O(l) ΔH=2596.7 kJ·mol1
⑤C3H8(g)+5O2(g)![]() 3CO2(g)+4H2O(l) ΔH=2217.8 kJ·mol1
3CO2(g)+4H2O(l) ΔH=2217.8 kJ·mol1
现由上述五种烃中的两种组成的混合气体2 mol,经充分燃烧后放出3037.6 kJ热量,则下列哪些组合是不可能的
A.C2H4和C2H6 B.C2H2和C3H8 C.C2H6和C3H8 D.C2H6和CH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修5:有机化学基础】
化合物F是一种重要的有机合成中间体。下面是以化合物A为原料合成化合物F的路线:

回答下列问题:
(1)化合物E中含氧官能团的名称是________________。
(2)以羟基为取代基,化合物A的化学名称是________________,A分子中最多有_______个原子共平面。
(3)D生成E的反应类型为_________________,由C生成D的化学方程式为_____________________。
(4)满足下列条件的E的芳香族同分异构体共有____________种(不含立体异构);
①能发生银镜反应和水解反应
②其水解产物之一能与FeCl3溶液发生显色反应
其中核磁共振氢谱显示为四组峰,且峰面积比为1∶2∶3∶6的一种同分异构体的结构简式为________________________。
(5)参照上述合成路线,以![]() 和CH2(COOH)2为原料(其他试剂任选),设计制备
和CH2(COOH)2为原料(其他试剂任选),设计制备![]() 的合成路线[已知:
的合成路线[已知:![]() ]:_________________________________________________________。
]:_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两个容积均为10L的密闭容器Ⅰ和Ⅱ中发生反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g),起始物质的量见下表。实验测得两容器不同温度下达到平衡时CO2的物质的量浓度如下图所示,下列说法错误的是
N2(g)+2CO2(g),起始物质的量见下表。实验测得两容器不同温度下达到平衡时CO2的物质的量浓度如下图所示,下列说法错误的是

容器 | 起始物质的量 | ||
NO | CO | ||
Ⅰ | 1mol | 0.5mol | |
Ⅱ | 2mol | 1mol | |
A. 反应N2(g)+2CO2(g)![]() 2NO(g)+2CO(g)的ΔH<0,ΔS>0
2NO(g)+2CO(g)的ΔH<0,ΔS>0
B. P点的速率比M点慢
C. M、N两点容器内的压强: P(M) <2P(N)
D. N点的平衡常数为44.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)相同质量的O2和O3,分子数之比为______;O原子数之比为_____;同温同压下密度比为_____。
(2)标准状况下;1.806×l023个CO2分子的体积为____L,与_____g H2O含有O 原子数目相同,此CO2气体与足量的Na2O2固体完全反应后,固体的质量增加______g。
(3)将4g NaOH固体溶于水配成500mL 溶液,所得溶液的物质的量浓度为___mol/L。
① 若从中取出10mL,加水稀释到50mL,则稀释后NaOH 溶液的物质的量浓度为___mol/L。
② 若从中取出10mL,需要加入0.5mol/L盐酸_______mL 才能恰好反应。
(4)标准状况下,将VL某气体(相对分子质最为M)溶解在aL水中(水的密度近似为1g/mL) , 所得溶液的密度为ρg/mL,则溶质的物质的量浓度为______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
H、C、N、O、W、Fe、V都是生活与化学工业中常见元素,请回答下列问题:
⑴碳负离子CH3-的空间构型为_______;根据等电子原理,NO+的电子式为________。
⑵N、Na+、Fe3+、Cu2+四种微粒基态的核外电子排布式中未成对电子数最多的是________;Cu2+在水中呈现蓝色是因为形成了水合铜离子,其化学式为______。

(3)钒可用于人工合成的二价钒固氮美酶(结构如图甲)。钒固氮酶中钒的配位原子有__________(填元素符号)。
(4)烟酰胺(结构如图乙)可用于合成光合辅酶NADPH,烟酰胺分子中氮原子的杂化轨道类型有______,1 mol该分子中含σ键的数目为________________。
(5)下图为碳化钨晶体的一部分结构,碳原子嵌入金属钨的晶格的间隙,并不破坏原有金属的晶格,形成填隙+固溶体,也称为填隙化合物。在此结构中,其中钨原子有______个,1个钨原子周围距离钨原子最近的碳原子有______个,假设该部分晶体的体积为Vcm3,碳化钨的摩尔质量为M g/mol,密度为b g/cm3,则阿伏加德罗常数NA用上述数据可以表示为___________________。
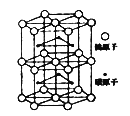
(6)12 g石墨烯(结构如图丙)中含有的正六边形的物质的量为_____mol;请你预测硅是否容易形成类似石墨烯的结构,并说明理由____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关100mL 0.1mol/L K2SO4溶液的叙述正确的是
A. 含有0.1molK2SO4 B. 水的体积为0.1L
C. c(K+)=0.2 mol/L D. 取出10mL溶液,c(K2SO4)=0.01mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素Se位于第四周期ⅥA族,下列说法不正确的是
A. Se的原子序数为34
B. 单质Se在空气中燃烧可生成SeO3
C. 可形成Na2SeO3、Na2SeO4两种盐
D. H2S比H2Se稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化钙(CaH2)固体是一种储氢材料,是登山运动员常用的能源提供剂。
I 、金属Ca 的部分性质有:
① 常温或加热条件下Ca都能与氧气反应;
② Ca常温遇水立即发生剧烈反应生成氢氧化钙和氢气,并放出大量的热;
③ Ca + H2=CaH2(固体)。
II 、固体CaH2的部分性质有:
① 常温:CaH2+ 2H2O = Ca(OH)2+2H2;②CaH2要密封保存。
(l)写出Ca常温遇水立即发生反应的化学方程式:_________;其中氧化剂为_________(填化学式)。
(2)用双线桥法标明反应CaH2+ 2H2O = Ca(OH)2+2H2中电子转移的方向和数目________________。
(3)取一定质量的钙,平均分成两等份,一份直接与水反应生成氢气,另一份先生成氢化钙,然后氢化钙与水反应生成氢气,如果不考虑中间的损失,理论上两份产生的氢气的物质的量比为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com