
下列说法正确的是
| A.电解质溶液能导电,是因为在通电时电解质电离产生了自由移动的离子 |
| B.饱和石灰水中加入少量CaO,恢复至室温后溶液的pH值不变 |
| C.将AlCl3溶液和Na2SO3溶液分别蒸干并灼烧,得到Al2O3和Na2SO3 |
| D.pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液、NaOH溶液,则溶液浓度大小关系: |
B
解析试题分析:电离与通电无关,当电解质溶液通入直流电时,溶液中的阴阳离子分别向阳极和阴极移动,参加有电子得失的电解反应,在阳极上失去电子,在阴极上得到电子,形成了电子的定向移动,因此电解质溶液能够导电。而不是产生了自由移动的离子,A选项不正确,饱和石灰水中加入少量CaO,恢复至室温后,有沉淀析出,因此还是饱和溶液,饱和溶液浓度不变,所以pH不变,B选项正确,因为Na2SO3容易氧化,所以Na2SO3溶液蒸干并灼烧,得到Na2SO4,C选项不正确,酸越弱,相应的钠盐越容易水解,酸性是醋酸>碳酸>苯酚>碳酸氢钠,所以碳酸钠的水解程度最大,碱性最强。由于氢氧化钠是强碱,因此在pH相同的条件下,氢氧化钠的浓度最小,p H相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液、NaOH溶液浓度大小关系为:c(CH3COONa)>c(C6H5ONa )>c(Na2CO3)>c(NaOH ),D选项不正确。
考点:盐类水解的应用等。


科目:高中化学 来源: 题型:单选题
25℃时对于pH=1的盐酸,下列叙述不正确的是
| A.c(H+)=c(Cl-)+c(OH-) |
| B.c(H+)·c(OH-)=1.0×10—14 |
| C.由水电离出的c(H+)=1.0×10-13mol?L-1 |
| D.与pH=13的NaOH溶液混合后,混合溶液一定呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期元素W、X、Y、Z的原子序数依次增大,它们的简单离子中都能破坏水的电离的组合是
| A.Y3+、W- | B.Z2-、X+ | C.X+、Y3+ | D.X+、Z2- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
25℃,有c(CH3COOH)+c(CH3COO-)="0.1" mol/L的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示。有关离子浓度关系分析正确的是
| A.pH=5.5溶液中:c(CH3COO-) >c(CH3COOH)>c(H+)>c(OH-) |
| B.W点表示溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| C.pH=3.5溶液中:c(Na+)-c(OH-)+c(CH3COOH)="0.1" mol/L |
| D.向W点所表示溶液中通入0.05molHCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
25℃时,弱酸的电离平衡常数如下表,下列表述错误的是
| 弱酸 | CH3COOH | HCN | H2CO3 |
| K | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法不正确的是
| A.将pH=4的某酸稀释10倍,测得其pH<5,则该酸为弱酸 |
B.0.1mol 的NaHCO3溶液中 的NaHCO3溶液中 |
C.0.1mol 的NaHA溶液Ph=5,则溶液: 的NaHA溶液Ph=5,则溶液: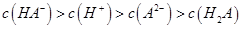 |
D.pH=4的醋酸与pH=10的氢氧化钠溶液等体积混合,所得溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在一定条件下发生下列反应,其中属于盐类水解反应的是
A.NH4++2H2O NH3·H2O+H3O+ NH3·H2O+H3O+ |
B.HCO3-+ H2O H3O+ + CO32- H3O+ + CO32- |
| C.HS-+H+= H2S |
D.Cl2+H2O  H++Cl-+HclO H++Cl-+HclO |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常见的无机酸25℃时在水溶液中的电离平衡常数如下表
| 无机酸 | 氢氰酸(HCN) | 碳酸(H2CO3) | 氢氟酸(HF) |
| 电离平衡常数K值 | 6.2×10—10(K) | 4.2×10—7(K1) 5.6×10—11(K2) | 6.61×10—4(K) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com