
铁是目前用途最广,用量最大的金属。运用所学知识,回答下列问题。
(1)鉴别Fe(OH)3胶体和FeCl3溶液的方法是 。
(2)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式: 。
(3)工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如下方案:
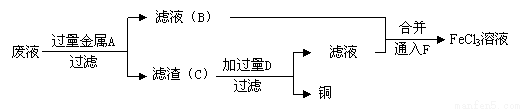
①滤渣C的化学式为 ;
②试剂F宜选用______(填选项序号),通入F的目的是_______________;
A.酸性KMnO4溶液 B.氯水 C.溴水
(4)某研究性学习小组为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,则待测液中含有的金属阳离子是 ;②溶液组成的测定:取30.0mL待测溶液,加入足量的AgNO3溶液,得25.83g白色沉淀。则溶液中c(Cl-)= 。
(1)用平行光照射两种分散系(或丁达尔现象) (2)2Fe3++Cu=2Fe2++Cu2+
(3)①Fe、Cu ②B 将溶液中的Fe2+转化为Fe3+(4)①Fe3+ 、Fe2+、Cu2+ ②6.0 mol·L-1
【解析】
试题分析:(1)胶体有丁达尔效应,溶液没有,则鉴别Fe(OH)3胶体和FeCl3溶液的方法是用平行光照射两种分散系,若有光亮的通路,是胶体,没有是溶液;
(2)FeCl3 中铁元素是+3价,最高价态,有氧化性,能被还原剂还原呈+2价,铜单质是0价最低价,具有还原性,能被氧化成+2价,所以离子方程式为2Fe3++Cu=2Fe2++Cu2+;
(3)向反应后的废液中加入过量的金属Fe,发生反应:Fe+CuCl2 =FeCl2 +Cu,,然后过滤得到滤液B中含有FeCl2 ;滤渣C中含有Fe、Cu。向滤渣中加入过量的盐酸,发生反应:Fe+2HCl= FeCl2 + H2↑。滤液E中含有FeCl2 ,将其与滤液B混合,然后向该溶液中滴加新制的过量的氯水,发生反应2FeCl2 +Cl2=2FeCl3。最后得到FeCl3 溶液。所以,①滤渣C的化学式为Fe、Cu;②试剂F宜选用B,通入F的目的是将溶液中的Fe2+转化为Fe3+;
(4)①检验Fe3+的试剂是KSCN,KSCN能使氯化铁溶液由黄色变成血红色,此现象是Fe3+的特征反应,则待测液中含有的金属阳离子是Fe3+ 、Fe2+、Cu2+,②氯化银的物质的量为25.83/143.5=0.18mol,根据Ag++Cl-=AgCl,则溶液中c(Cl-)=0.18/0.03=6.0 mol·L-1。
考点:考查溶液和胶体的鉴别,氧化还原反应,铜、铁及化合物的性质。


科目:高中化学 来源:2014-2015甘肃省高二上学期期末考试化学试卷(解析版) 题型:选择题
下列有关电解池的说法正确的是
A.在电解池中与外接电源负极相连的电极是阳极
B.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为2∶1
C.电解氯化铜溶液时,在阴极上有气体生成
D.电解稀硫酸溶液,实质上是电解水,故溶液pH不变
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省高二上学期期中化学(理)试卷(解析版) 题型:选择题
用已被部分氧化的金属屑A制备某工业常用盐C的步骤如下:
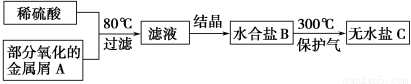
将C溶于水,向其中滴入NaOH溶液,出现白色沉淀,后逐渐变为红褐色,下列判断正确的是
A.过滤所得的残渣中一定没有金属A
B.滤液可能是CuSO4溶液或MgSO4溶液
C.水合盐B可能是FeSO4·7H2O
D.无水盐C可能是Fe2(SO4)3
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省高二上学期期中化学(理)试卷(解析版) 题型:选择题
第3周期元素形成的单质中,属于原子晶体的是
A.单晶硅 B.金刚石 C.金刚砂 D.二氧化碳
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省高二上学期期中化学(理)试卷(解析版) 题型:选择题
某微粒的核外电子的数目分别为:K层2个,L层8个,M层8个,该微粒一定是
A.氩原子 B.钾离子 C.氯离子 D.无法确定
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省高一上学期期末考试化学试卷(解析版) 题型:选择题
甲、乙两种溶液中分别含有大量的Cu2+、K+、H+、Cl-、CO32-、OH-这6种离子中的3种(两种溶液中的离子不重复),已知甲溶液呈蓝色,则乙溶液中大量存在的离子是
A.K+、OH-、CO32- B.Cu2+、H+、Cl-
C.K+、H+、Cl- D.CO32-、OH-、Cl-
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省高一上学期期末考试化学试卷(解析版) 题型:选择题
对于溶液中某些离子的检验及结论一定正确的是
A.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,则一定有SO
B.加入NaOH固体,产生的气体能使湿润红色石蕊试纸变蓝,则一定有NH4+
C.先滴加氯水,再滴加KSCN溶液后显红色,则一定有Fe2+而没有Fe3+
D.滴加硝酸银,生成白色沉淀,再滴加稀盐酸,沉淀不溶解,则含有Cl-
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省高二上学期期末考试化学试卷(解析版) 题型:实验题
(14分)某学生用0.1000 mol·L-1的NaOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
A.移取20 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;
D.取标准NaOH溶液注入碱式滴定管至刻度0以上2~3 cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)______________________________。
(2)上述B步骤操作的目的是_______________________________________。
(3)实验中用左手控制活塞,眼睛注视 ___________________,直至滴定终点。判断到达终点的现象是________________________________。
(4)某学生根据3次实验分别记录有关数据如下表:
滴定 次数 | 待测溶液的体积(mL) | 0.100 0 mol·L-1NaOH的体积(mL) | ||
滴定前刻度 | 滴定后刻度 | 溶液体积(mL) | ||
第一次 | 20.00 | 0.00 | 26.11 | 26.11 |
第二次 | 20.00 | 1.56 | 30.30 | 28.74 |
第三次 | 20.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式计算该盐酸溶液的物质的量浓度为
(5)用0.1000 mol·L-1 NaOH溶液滴定0.1000 mol·L-1盐酸,如达到滴定的终点时不慎多加了1滴NaOH溶液(1滴溶液的体积约为0.05 mL),继续加水至50 mL,所得溶液的pH等于____________
(6)下列哪些操作会使测定结果偏高 (填序号)。
A.锥形瓶中溶液的颜色刚刚由无色变为浅红色即停止滴定
B.碱式滴定管用蒸馏水洗净后立即注入标准液
C.滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
E.实验中,用待盛装的溶液润洗锥形瓶
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省高二上学期期中化学试卷(解析版) 题型:选择题
下列有关物质的性质或应用的说法正确的是
A.在甲苯中加入少量酸性高锰酸钾溶液,振荡后褪色,正确的解释是由于侧链与苯环的相互影响,使侧链和苯环均易被氧化
B.用核磁共振氢谱鉴别1—丙醇和2—丙醇
C.间二溴苯仅有一种空间结构可证明苯分子中不存在单双键交替的结构
D.甲烷、乙烯和苯在工业上都可通过石油分馏得到
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com