
【题目】爱国实业家侯德榜在氨碱法的基础上,发明了“联合制碱法”,简单流程如图。完成下列问题:
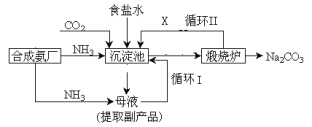
(1)写出通入CO2和NH3的化学反应方程式_________________________________________________。在 饱和食盐水中通入CO2和NH3,先通NH3后通CO2的原因是_____________________________。
(2)母液中除H+和OH-外,还含有的离子是_____________。 向母液中通氨气,加入细小食盐颗粒,冷却 析出副产品,通氨气的作用有____________。
(a)增大NH4+的浓度,使NH4Cl更多地析出
(b)使NaHCO3更多地析出
(c)使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(3)上述流程中X物质的分子式_______。使原料氯化钠的利用率从70%提高到90%以上,主要是 设计了_______(填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是____。
(4)写出检验产品碳酸钠中是否含有氯化钠的简要方案:___________________________________________________________________________________。
(5)工业生产的纯碱常会含少量NaCl杂质。现用重量法测定其纯度,步骤如下:
称取样品ag,加水溶解,加入足量的BaCl2溶液,经过滤、洗涤、干燥,最终得到固体bg。样品中纯 碱的质量分数为___________________(用含a、b的代数式表示)。
【答案】NaCl + NH3+CO2 +H2O → NaHCO3↓+NH4Cl 氨气在水中溶解度大,先通氨气有利于生成碳酸氢钠沉淀。 Na+、HCO3-、NH4+、Cl- a、c CO2 I 过滤 可取少量试样溶于水后,再滴加足量的稀硝酸和少量的硝酸银溶液,若产生白色沉淀不溶解,说明有Cl- 106 b/197a
【解析】
联合制碱法:以食盐、氨和二氧化碳为原料来制取纯碱,二氧化碳在水中的溶解度小,与水反应形成不稳定的碳酸,而把二氧化碳通入溶有氨气而呈碱性的水中,会使生成的碳酸与氨水发生反应,而增大二氧化碳气体的吸收,将氨通入饱和食盐水而成氨盐水,再通入二氧化碳生成碳酸氢钠沉淀,反应为:CO2+H2O+NaCl+NH3=NaHCO3↓+NH4Cl,经过滤、洗涤得NaHCO3微小晶体,再加热制得纯碱产品,其滤液是含有氯化铵和氯化钠的溶液,从含有氯化铵和氯化钠的滤液中结晶沉淀出氯化铵晶体,由于氯化铵在常温下的溶解度比氯化钠要大,低温时的溶解度则比氯化钠小,在低温条件下,向滤液中加入细粉状的氯化钠,并通入氨气,可以使氯化铵单独结晶沉淀析出,经过滤、洗涤和干燥即得氯化铵产品。
(1)二氧化碳通入氨化的饱和氯化钠溶液中反应生成碳酸氢钠晶体,反应为:CO2+H2O+NaCl+NH3=NaHCO3↓+NH4Cl;二氧化碳微溶于水,先通入二氧化碳,溶液中生成极少量的碳酸,且碳酸不稳定,再通入氨气,生成的产物量少,且易生成碳酸铵,氨气在水中溶解度很大,先通入氨气,溶液中生成较多的一水合氨,再通入CO2,生成的产物量多,且易生成碳酸氢铵;故答案为:NaCl+NH3+CO2+H2O→NaHCO3↓+NH4Cl;氨气在水中溶解度大,先通氨气有利于生成碳酸氢钠沉淀;
(2)由上述分析可知,母液中除H+和OH-外,还含有的离子是Na+、HCO3-、NH4+、Cl-;氨气溶于水后生成氨水,氨水电离成铵根,增大铵根的浓度有利于氯化铵析出来,故a正确;通入氨气使溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,可以提高氯化铵的纯度,所以选项c正确,选项b错误;故答案为:Na+、HCO3-、NH4+、Cl-; a、c;
(3)侯氏制碱法反应方程式为NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓,得到碳酸氢钠同时得到氯化铵,二氧化碳是反应的原料同时也是反应的副产物,可以循环利用,故X是二氧化碳;因为氯化钠最后剩余在母液中,所以循环I是氯化钠的循环,使原料氯化钠的利用率提高;分离沉淀的方法是过滤;故答案为:CO2;I;过滤;
(4)要检验碳酸钠中含有氯化钠,需要先加硝酸将碳酸钠除去,然后加入硝酸银溶液,若有沉淀产生,说明碳酸钠中含有氯化钠,否则不含氯化钠;故答案为:可取少量试样溶于水后,再滴加足量的稀硝酸和少量的硝酸银溶液,若产生白色沉淀不溶解,说明有Cl-;
(5)加入足量的 BaCl2溶液:发生反应:Na2CO3+BaCl2=BaCO3↓+2NaCl,Na2CO3~BaCO3,根据原子守恒,通过称量沉淀碳酸钡的质量,来计算样品中纯碱的质量分数,需洗涤沉淀,除去杂质离子,且将沉淀冷却到室温,恒重操作后最终得到固体 b(g)为BaCO3,根据碳守恒,纯碱的质量分数=![]() ;故答案为:
;故答案为: ![]() 。
。


科目:高中化学 来源: 题型:
【题目】中华传统文化蕴含着很多科学知识,下列说法错误的是
A. “丹砂(HgS烧之成水银,积变又还成丹砂”描述的是可逆反应
B. “水声冰下咽,沙路雪中平”未涉及化学变化
C. “霾尘积聚难见路人”形容的霾尘中有气溶胶,具有丁达尔效应
D. “含浆似注甘露钵,好与文园止消渴”说明柑橘糖浆有甜味,可以止渴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A.①CaCO3(s)=CaO(s)+CO2(g) ΔH=-177.7 kJ/mol
②0.5H2SO4(l)+NaOH(l)=0.5Na2SO4(l)+H2O(l) ΔH=-57.3 kJ/mol
③C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
④CO(g)+![]() O2(g)=CO2(g) ΔH=-283 kJ/mol
O2(g)=CO2(g) ΔH=-283 kJ/mol
⑤HNO3(aq)+NaOH(aq)=NaNO3(aq)+H2O(l) ΔH=-57.3 kJ/mol
(1)上述热化学方程式中,不正确的有____________________。(填序号,以下同)
(2)上述反应中,表示燃烧热的热化学方程式是____________________________;上述反应中,表示中和热的热化学方程式是________________________。
B.已知热化学方程式:C(s,金刚石)+O2(g)=CO2(g) ΔH=-395.41 kJ/mol;C(s,石墨)+O2(g)=CO2(g) ΔH=-393.51 kJ/mol
(3)则金刚石转化为石墨的热化学方程式为_____,由热化学方程式看来更稳定的碳的同素异形体是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用膜技术原理和电化学原理制备少量硫酸和绿色硝化剂N2O5,装置如图所示,下列说法正确的是( )
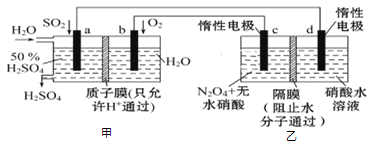
A. 电极b反应式是O2+4e-+2H2O=4OH-
B. 电解后乙装置d电极附近溶液的pH不变
C. c电极上的电极反应式为N2O4-2e-+H2O=N2O5+2H+
D. 甲中每消耗1mol SO2,乙装置中有1mol H+通过隔膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修3:物质结构与性质]
金属材料在国民经济建设等领域具有重要应用,镁、镍、铜是几种重要的金属元素,请回答下列问题:
(1)镍元素的核电荷数为28,则原子基态电子排布式为 ________ ,结构中有 ___ 种不同形状的电子云。
(2)MgO的熔点高于CuO的原因是__________________________
(3)Mg元素的第一电离能反常地高于同周期后一种元素,原因是_____________________
(4)Ni与CO能形成配合物Ni(CO)4,该分子中σ键与π键个数比为 _____________________
(5)配合物[Cu(CH3C≡N)4]BF4中碳原子杂化轨道类型为______ ,BF4-的空间构型为_________________ 。
(6)铜与氧元素可形成如图所示的晶胞结构,其中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(1/2,1/2,1/2),则d的坐标参数为 ____________,已知该品体的密度为ρg/cm3,NA是阿伏加德罗常数值,则晶胞参数为 _______________ cm(列出计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是
A.pH=2的溶液:Na+、Fe3+、Cl-、![]()
B.c(NaAlO2)=0.1 mol·L-1的溶液:K+、H+、Cl-、![]()
C.c(OH-)<![]() 的溶液:Na+、K+、
的溶液:Na+、K+、![]() 、ClO-
、ClO-
D.c(Fe3+)=0.1 mol·L-1的溶液:Al3+、![]() 、
、![]() 、SCN-
、SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是( )

A. Mg 电极是该电池的正极
B. H2O2在石墨电极上发生氧化反应
C. 石墨电极附近溶液的pH 增大
D. 溶液中Cl-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.澄清石灰水中加入过量小苏打溶液:![]() +Ca2++OH-=CaCO3↓+H2O
+Ca2++OH-=CaCO3↓+H2O
B.苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O ===2C6H5OH↓+![]()
C.潮湿环境中钢铁发生电化学腐蚀的反应:Fe+2H2O=Fe(OH)2+H2↑
D.酸性溶液中KIO3与KI反应生成I2:![]() +5I-+6H+=3I2+3H2O
+5I-+6H+=3I2+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备丙烯的方法有多种,具体如下(本题丙烯用C3H6表示):
(1)丙烷(C3H8)脱氢制备丙烯(C3H6)
由下图可得,C3H8(g)![]() C3H6(g)+H2(g),△H=_________kJ/.mol
C3H6(g)+H2(g),△H=_________kJ/.mol

(2)用惰性电极电解CO2的酸性溶液可得丙烯(C3H6),其原理如下图所示。则b的电极反应式为__________。

(3)以丁烯(C4H8)和乙烯(C2H4)为原料反应生成丙烯(C3H6)的方法被称为“烯歧化法”,反应为:C4H8(g)+C2H4(g)![]() 2C3H6(g) △H>0
2C3H6(g) △H>0
一定温度下,在一体积恒为VL的密闭容器中充入一定量的C4H8和C2H4,发生烯烃歧化反应。
I.该反应达到平衡的标志是______________
a.反应速率满足:2v生成(C4H8)=v生成(C3H6)
b.C4H8、C2H4、C3H6的物质的量之比为1:1:2
c.混合气体的平均相对分子质量不再改变
d.C4H8、C2H4、C3H6的浓度均不再变化
Ⅱ.已知t1min时达到平衡状态,测得此时容器中n(C4H8)=mmol,n(C2H4)=2mmol,n(C3H6)=nmol,且平衡时C3H6的体积分数为![]() 。
。
①该时间段内的反应速率v(C4H8)= _______mol/(L·min)。(用只含m、V、t1的式子表示)。
②此反应的平衡常数K=______________。
③t1min时再往容器内通入等物质的量的C4H8和C2H4,在新平衡中C3H6的体积分数_______![]() (填“>”“<”“=”)。
(填“>”“<”“=”)。
(4)“丁烯裂解法”是另一种生产丙烯的方法,但生产过程中伴有生成乙烯的副反应发生,具体反应如下:主反应:3C4H8![]() 4C3H6;副反应:C4H8
4C3H6;副反应:C4H8![]() 2C2H4
2C2H4
①从产物的纯度考虑,丙烯和乙烯的质量比越高越好。则从下表现的趋势来看,下列反应条件最适宜的是__________(填字母序号)。
a.300℃0.1MPa b.700℃0.1MPa c.300℃0.5MPa d.700℃0.5MPa
②下图中,平衡体系中丙烯的百分含量随压强增大呈上升趋势,从平衡角度解释其可能的原因是_____。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com