
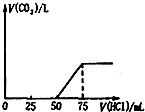
 取一定物质的量浓度的NaOH 溶液1 00mL,然后向其通入一定量的CO2气体,得到溶液A,向A 中逐滴缓慢加入0.1mol/L的HCl溶液,产生的CO2气体体积(标准状况)与所加HCl溶液的体积之间关系如图所示,下列有关说法不正确的是( )
取一定物质的量浓度的NaOH 溶液1 00mL,然后向其通入一定量的CO2气体,得到溶液A,向A 中逐滴缓慢加入0.1mol/L的HCl溶液,产生的CO2气体体积(标准状况)与所加HCl溶液的体积之间关系如图所示,下列有关说法不正确的是( )| A. | A溶液中溶质Na2CO3和NaHCO3物质的量比为l:l | |
| B. | A溶液中溶质NaOH和Na2CO3物质的量比为l:l | |
| C. | 原Na0H 溶液物质的量浓度为0.075mol/L | |
| D. | 通入CO2气体在标况下的体积为56mL |
分析 CO2与NaOH溶液反应有如下两种“边界”情况:
CO2+2NaOH=Na2CO3+H2O…①
CO2+NaOH=NaHCO3…②
故反应后溶液中溶质的成分可有如下可能:Na2CO3和NaOH、Na2CO3、Na2CO3和NaHCO3、NaHCO3;
当将稀盐酸逐滴滴到碳酸钠溶液中时,Na2CO3跟盐酸的反应是分步进行的:
Na2CO3+HCl=NaHCO3+NaCl…③
NaHCO3+HCl=NaCl+H2O+CO2↑…④
并且可以看出,当反应完全进行时,两个过程消耗HCl的量相等.
若溶液中还有氢氧化钠,则首先发生反应:NaOH+HCl=NaCl+H2O…⑤
50mL~75mL发生的反应为HCO3-+H+=H2O+CO2↑,小于50mL,说明加入盐酸50mL前发生的反应分别为H++OH-=H2O,
CO32-+H+=HCO3-,结合反应的离子方程式和质量守恒的角度解答该题.
解答 解:CO2与NaOH溶液反应有如下两种“边界”情况:
CO2+2NaOH=Na2CO3+H2O…①
CO2+NaOH=NaHCO3…②
故反应后溶液中溶质的成分可有如下可能:Na2CO3和NaOH、Na2CO3、Na2CO3和NaHCO3、NaHCO3;
当将稀盐酸逐滴滴到碳酸钠溶液中时,Na2CO3跟盐酸的反应是分步进行的:
Na2CO3+HCl=NaHCO3+NaCl…③
NaHCO3+HCl=NaCl+H2O+CO2↑…④
并且可以看出,当反应完全进行时,两个过程消耗HCl的量相等.
若溶液中还有氢氧化钠,则首先发生反应:NaOH+HCl=NaCl+H2O…⑤
设反应产生CO2 之前消耗盐酸的体积为V1,从开始产生CO2 至反应结束消耗盐酸的体积为V2.
将各种反应的情况总结如下表:
| 溶液中溶质的成分 | Na2CO3和NaOH | Na2CO3 | Na2CO3和NaHCO3 | NaHCO3 | NaHCO3 |
| 向溶液中逐滴加入稀盐酸发生的反应 | 依次是⑤③④ | 依次是③④ | 依次是③④ | ④ | ④ |
| V1与V2的关系 | V1>V2 | V1=V2 | V1<V2 | V1=0,V2>0 | V1=0,V2>0 |
点评 本题考查混合物的计算,题目难度中等,注意从图象分析反应可能的情况进行判断和计算,本题关键是根据图象判断溶液溶质的成分.


科目:高中化学 来源: 题型:解答题
 元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大.其中 D、F为常见金属元素;A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g•L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(如图,其它参与反应的物质未列出):
元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大.其中 D、F为常见金属元素;A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g•L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(如图,其它参与反应的物质未列出):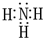 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 115mol/L | B. | 1mol/L | C. | 3mol/L | D. | 2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
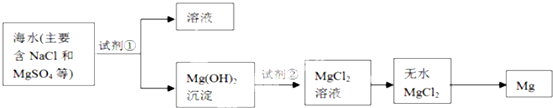

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaSO4难溶于水,属于非电解质 | |
| B. | SO2能与碱反应生成盐和水,属于酸性氧化物 | |
| C. | NH4Cl组成中不含金属离子,不属于盐 | |
| D. | NaHSO4能电离出H+,NaHSO4属于盐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com