
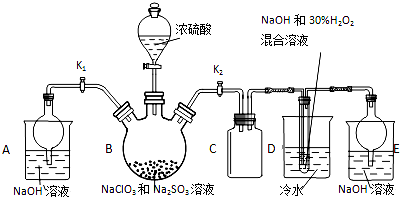
 亚氯酸钠(NaClO2)是重要漂白剂,探究小组开展如下实验,请回答:
亚氯酸钠(NaClO2)是重要漂白剂,探究小组开展如下实验,请回答:分析 B中反应为NaClO3和Na2SO3在浓H2SO4的作用生成 ClO2和Na2SO4,C可防止倒吸,起到安全瓶的作用,D中加入过氧化氢和氢氧化钠,在低温下反应生成NaClO2,A和E都为尾气处理装置.
(1)装置D中发生气体反应,装置内压强降低,装置C的作用是安全瓶,防止D瓶溶液倒吸到B瓶中;
(2)装置B中制备得到ClO2,所以B中反应为NaClO3和Na2SO3在浓H2SO4的作用生成 ClO2和Na2SO4,装置D反应后的溶液获得NaClO2晶体,装置D中生成NaClO2,Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,结合原子守恒可知,还有水生成,配平书写方程式;B制得的气体中含有SO2,在装置D中被氧化生成硫酸,可以用利用硫酸钡是白色沉淀检验硫酸根;
(3)从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,注意温度控制;
(4)由题目信息可知,应控制温度38℃~60℃,高于60℃时NaClO2分解成NaClO3和NaCl;
(5)根据化学反应可得关系式:NaClO2~2I2~4S2O32-,令样品中NaClO2的物质的量x,根据关系式计算.
解答 解:(1)装置D中发生气体反应,装置内压强降低,装置C的作用是安全瓶,防止D瓶溶液倒吸到B瓶中,故答案为:防止D瓶溶液倒吸到B瓶中;
(2)装置B中制备得到ClO2,反应的化学反应方程式为2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O;装置D反应后的溶液获得NaClO2晶体,装置D中生成NaClO2,Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,结合原子守恒可知,还有水生成,配平后方程式为2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;B制得的气体中含有SO2,在装置D中被氧化生成硫酸,溶液中可能存在SO42-;用氯化钡溶液检验SO42-,具体操作:取少量反应后的溶液,先加足量的盐酸,再加BaCl2溶液,若产生白色沉淀,则说明含有SO42-,
故答案为:2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O;2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;SO42-;先加足量的盐酸,再加少量BaCl2溶液,若产生白色沉淀则说明含有SO42-;
(3)从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,为防止析出晶体NaClO2•3H2O,应趁热过滤,由题目信息可知,应控制温度38℃~60℃进行洗涤,低于60℃干燥,故答案为:趁热过滤;60℃;
(4)由于ClO2和SO2均有毒,所以反应结束后,打开K1,装置A起的作用是吸收装置B中多余的ClO2和SO2;由题目信息可知,应控制温度38℃~60℃,高于60℃时NaClO2分解成NaClO3和NaCl,所以如果撤去D中的冷水浴,可能导致产品中混有的杂质是NaClO3和NaCl,
故答案为:吸收装置B中多余的ClO2和SO2,防止污染空气;NaClO3和NaCl;
(5)令样品中NaClO2的物质的量n,则:
NaClO2~2I2~4S2O32-
1mol 4mol
n/4 c mol•L-1×V×10-3L
故n=c•V•10-3mol.
故答案为:c•V•10-3 mol.
点评 本题考查亚氯酸钠制备实验的基本操作、亚氯酸钠的性质及中和滴定等知识,为高频考点,理解原理是解题的关键,同时考查学生分析问题、解决问题的能力,难度较大


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | KAl(SO4)2═K++Al3++SO42- | B. | NaH2PO4═Na++H2PO4- | ||
| C. | H2S?2H++S2- | D. | NaClO═Na++Cl-+O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.15NA | B. | 0.6NA | C. | 1.2NA | D. | 2.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.实验步骤如下:
在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
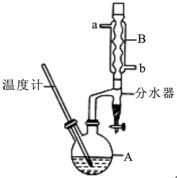 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:2CH3CH2CH2CH2OH$→_{△}^{浓硫酸}$CH3CH2CH2CH2)2O,反应物和产物的相关数据如下表:
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:2CH3CH2CH2CH2OH$→_{△}^{浓硫酸}$CH3CH2CH2CH2)2O,反应物和产物的相关数据如下表:| 相对分子质量 | 沸点/℃ | 密度/(g/cm3) | 水中的溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓H2SO4有强氧化性,常温下能与Cu发生剧烈反应 | |
| B. | 金刚石是自然界中硬度最大的物质,不可能与氧气发生反应 | |
| C. | 明矾[KAl(SO4)2•12H2O]在水中能形成Al(OH)3胶体,可用作净水剂 | |
| D. | 将SO2通入品红溶液中,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com