
| A. | 向NaHCO3溶液中加入足量的Ba(OH)2溶液2HCO3-+Ba2++2OH-═BaCO3↓+CO32-+2H2O | |
| B. | 向石灰石中滴加稀硝酸CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 用惰性电极电解KOH溶液时阴极电极反应2H2O-4e-═O2+4H+ | |
| D. | NaOH溶液中通入少量硫化氢气体:2OH-+H2S═S2-+2H2O |
分析 A.二者反应生成碳酸钡、NaOH和水;
B.二者反应生成可溶性硝酸钙、二氧化碳和水;
C.用惰性电极电解KOH溶液时,阴极上水得电子生成氢气和氢氧根离子;
D.NaOH溶液中通入少量硫化氢气体生成硫化钠.
解答 解:A.二者反应生成碳酸钡、NaOH和水,离子方程式为Ba2++OH-+HCO3-=BaCO3↓+H2O,故A错误;
B.二者反应生成可溶性硝酸钙、二氧化碳和水,离子方程式为CaCO3+2H+═Ca2++CO2↑+H2O,故B正确;
C.用惰性电极电解KOH溶液时,阴极上水得电子生成氢气和氢氧根离子,离子方程式为2H2O+4e-═H2↑+2OH-,故C错误;
D.NaOH溶液中通入少量硫化氢气体生成硫化钠,离子方程式为2OH-+H2S═S2-+2H2O,故D正确;
故选BD.
点评 本题考查离子方程式正误判断,为高频考点,明确离子性质及离子方程式书写规则是解本题关键,侧重考查氧化还原反应、复分解反应,注意AD产物与反应物的量有关,题目难度不大.


科目:高中化学 来源: 题型:解答题
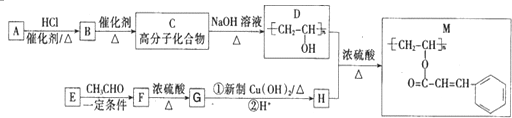
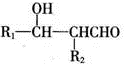
 .
. ;H的顺式结构简式为
;H的顺式结构简式为 .
. (任写一种).
(任写一种).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
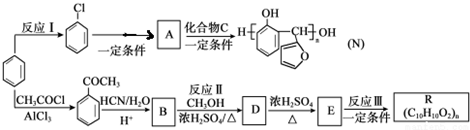
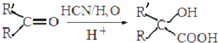
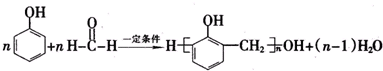
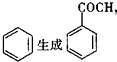 的反应类型是取代反应,D生成E的过程中,浓硫酸的作用是催化剂和脱水剂•
的反应类型是取代反应,D生成E的过程中,浓硫酸的作用是催化剂和脱水剂•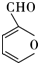
 .
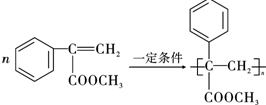
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
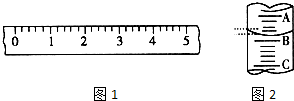 (1)某学生用托盘天平称量一个小烧杯的质量,如小烧杯的质量为32.6g,用“↓”表示在托盘上放砝码,“↑”表示从托盘上取砝码,请用箭头在下表中填空,表示称量过程,并在图1所示的游码尺上画出游码的位置(画“|”表示).
(1)某学生用托盘天平称量一个小烧杯的质量,如小烧杯的质量为32.6g,用“↓”表示在托盘上放砝码,“↑”表示从托盘上取砝码,请用箭头在下表中填空,表示称量过程,并在图1所示的游码尺上画出游码的位置(画“|”表示).| 砝码质量/g | 50 | 20 | 20 | 10 | 5 |
| 取用砝码情况 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4(m+n) | B. | 22.4×6.02×1023(m+n) | ||
| C. | 22.4×6.02×1032(m+n) | D. | $\frac{6.02×1{0}^{23}(m+n)}{22.4}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.025 mol | B. | 0.050 mol | C. | 0.100 mol | D. | 0.200 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 草酸与酸性高锰酸钾溶液反应:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O | |
| B. | 硫代硫酸钠与硫酸的离子方程式:S2O32-+2H+═SO2↑+S↓+H2O | |
| C. | KI溶液中滴加稀硫酸,敞口放置:2H++2I-+O2═I2+2H2O | |
| D. | K2Cr2O7的溶液中存在的平衡体系:Cr2O72-+H2O?2CrO42-+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸;②Na+水;③Al+NaOH溶液.请回答下列问题:
某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸;②Na+水;③Al+NaOH溶液.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com