
(10分)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比C12、O2、C1O2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:
2FeSO4 + a Na2O2 = 2Na2FeO4 + b X + 2Na2SO4 + c O2↑
①该反应中物质X应是 ,a与c的关系是 。
②简要说明K2FeO4作为水处理剂时,在水处理过程中所起的作用
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、C1O-、OH-、FeO42-、C1-、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式: 。
②每生成1mol FeO42-转移 mo1电子,若反应过程中转移了0.3mo1电子,则还原产物的物质的量为 mo1。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明什么问题 。
(1) ①Na2O (1分) a=4+2c (2分)
②高铁酸钾具有强氧化性,能杀菌消毒;消毒过程中自身被还原为Fe3+,Fe3+水解生成Fe(OH)3胶体能吸附水中悬浮杂质而沉降(2分)
(2) ①2Fe(OH)3 + 3ClO- + 4OH- = 2FeO42- + 3Cl- + 5H2O (2分)
②3(1分) 0.15(1分)
③该温度下K2FeO4比Na2FeO4的溶解度小(1分)
【解析】(1)①根据原子守恒和电子的得失守恒可知,X应该是氧化钠;根据方程式可知,过氧化钠中氧元素的化合价从-1价部分降低到-2价,得到1个电子,而部分升高到0价,失去1个电子。另外铁元素的化合价从+2价升高到+6价,失去4个电子,所以根据电子的得失守恒可知,2×4+2c=2a-2c,解得a=4+2c。
②由于高铁酸钾具有强氧化性,能杀菌消毒;消毒过程中自身被还原为Fe3+;Fe3+水解生成Fe(OH)3胶体能吸附水中悬浮杂质而沉降,所以高铁酸钾起杀菌和净水的作用。
(2)①根据元素的化合价变化可知,铁元素的化合价从+3价升高到+6价,失去3个电子.而氯元素的化合价从+1价降低到-1价,得到2个电子,所以根据电子的得失守恒可知,反应的方程式是2Fe(OH)3 + 3ClO- + 4OH- = 2FeO42- + 3Cl- + 5H2O。
②根据方程式可知,每生成1mol FeO42-转移3mol电子;若反应过程中转移了0.3mo1电子,则还原产物氯离子的物质的量是0.3mol÷2=0.15mol。
③由于该温度下K2FeO4比Na2FeO4的溶解度小,所以低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
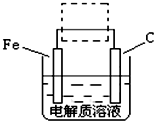 (FeSO4?7H2O)一起净水,其原理为
(FeSO4?7H2O)一起净水,其原理为 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH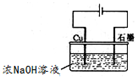 溶液的pH为
溶液的pH为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com