
| A. | CH3COOH | B. | Na2O | C. | H2SO4 | D. | SO2 |
科目:高中化学 来源: 题型:选择题
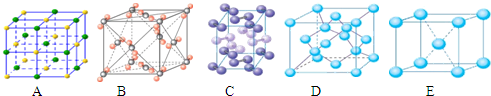
 高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价.如右图所示为超氧化钾晶体的一个晶胞,则下列说法正确的是( )
高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价.如右图所示为超氧化钾晶体的一个晶胞,则下列说法正确的是( )| A. | 超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2- | |
| B. | 晶体中每个K+周围有8个O2-,每个O2-周围有8个K+ | |
| C. | 晶体中与每个K+距离最近的K+有8个 | |
| D. | 晶体中与每个K+距离最近的K+有6个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1mol/LNaHCO3溶液中:c(Na+)>c(HCO3-)>C(CO32-)>c(H2CO3) | |
| B. | 在0.1mol/LNa2CO3溶液中:c(OH-)-c(H+)=c(HC03-)+c(H2CO3) | |
| C. | 向0.2mol/LNaHCO3溶液中加入等体积0.1mol/LNaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1mol/L]:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第ⅠA族元素都是典型的金属元素 | |
| B. | 第三周期的元素的原子核外都有三个电子层 | |
| C. | F、Cl、O、N四种元素都是第ⅦA族的元素 | |
| D. | 原子的最外层有两个电子的元素都在第ⅡA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
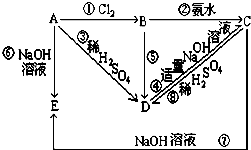 已知A为金属单质,根据下列变化完成以下问题:
已知A为金属单质,根据下列变化完成以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
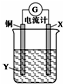
| A. | X可以是银或石墨 | B. | 电子从铜电极经外电路流向X电极 | ||
| C. | Y是硫酸铜溶液 | D. | X极上的电极反应式为Ag++e-═Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学性质较活泼的金属为负极 | B. | 在正极上发生氧化反应 | ||
| C. | 在外电路,电子流出的极为正极 | D. | 是由电能转化为化学能的装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
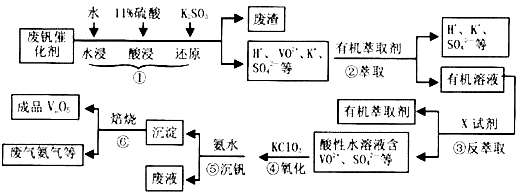
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com