
| A. | 32 g | B. | 32 g/mol | C. | 34 g | D. | 34 g/mol |
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在元素周期表前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C的氧化物是导致酸雨的主要物质之一,D原子核外电子有8种不同的运动状态,E的基态原子在前四周期元素的基态原子中单电子数最多,F元素的基态原子最外能层只有一个电子,其它能层均已充满电子.
在元素周期表前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C的氧化物是导致酸雨的主要物质之一,D原子核外电子有8种不同的运动状态,E的基态原子在前四周期元素的基态原子中单电子数最多,F元素的基态原子最外能层只有一个电子,其它能层均已充满电子. ; A2D由液态形成晶体时密度减小,其主要原因水形成晶体时,每个水分子与4个水分子形成氢键,构成空间正四面体网状结构,水分子空间利用率低,密度反而减小(用文字叙述).
; A2D由液态形成晶体时密度减小,其主要原因水形成晶体时,每个水分子与4个水分子形成氢键,构成空间正四面体网状结构,水分子空间利用率低,密度反而减小(用文字叙述).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定有银、铁和镁 | B. | 仅有银和铁 | C. | 可能含镁 | D. | 只有银 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 大气压强对许多物理实验和化学实验有着重要影响.
大气压强对许多物理实验和化学实验有着重要影响.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 25℃ | pH | 25℃ | pH |
| 饱和H2S溶液 | 3.9 | FeS开始沉淀 | 3.0 |
| SnS沉淀完全 | 1.6 | FeS沉淀完全 | 5.5 |
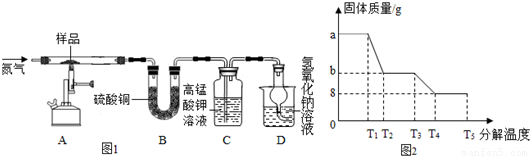
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2的生成速率与I2的生成速率相等 | |
| B. | 若单位时间内生成n mol H2的同时生成2n mol HI | |
| C. | H2、I2、HI的浓度相等 | |
| D. | 反应容器内的压强不随时间的变化而变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com