
| A. | 电子的能量越低,运动区域离原子核越远 | |
| B. | 核外电子的分层排布即是核外电子的分层运动 | |
| C. | 稀有气体元素原子的最外层都排有8个电子 | |
| D. | 当M层是最外层时,最多可排18个电子 |
分析 A.原子核外区域能量不同,距核由近到远,能量由低到高;
B.电子在原子中处于不同的能级状态,按能量不同分层排布;
C.氦原子的最外层电子数为2;
D.由电子排布规律可知,M层最多容纳18个电子,但为最外层时最多容纳8个电子.
解答 解:A.原子核外区域能量不同,距核由近到远,能量由低到高,即离原子核近的电子能量低,离原子核远的电子能量高,故A错误;
B.电子在原子中处于不同的能级状态,按能量不同分层排布,即电子在核外是分层排布,故B正确;
C.He最外层电子数为2,其它元素最外层电子数为8,故C错误;
D.由电子排布规律可知,M层最多容纳18个电子,但为最外层时最多容纳8个电子,故D错误.
故选B.
点评 本题主要考查原子核外电子排布,熟悉原子结构及电子排布规律即可解答,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ①③⑤ | C. | ①③④ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
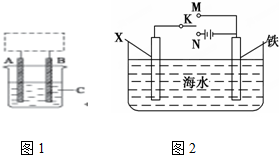 (I)研究CO2的利用对促进低碳社会的构建具有重要的意义.将CO2与焦炭作用生成CO,CO可用于炼铁等.
(I)研究CO2的利用对促进低碳社会的构建具有重要的意义.将CO2与焦炭作用生成CO,CO可用于炼铁等.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该气体有毒、无味、密度比空气大 | |
| B. | 将该气体通入紫色石蕊溶液中,石蕊熔液先变红后褪色 | |
| C. | 该气体的性质活泼,它与氢气混合后立即发生爆炸 | |
| D. | 室温下该气体能用钢瓶贮运,所以该气体不与铁反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Ba(HCO3)2与NaOH溶液反应 | B. | NaHCO3与Ba(OH)2溶液反应 | ||
| C. | Ba(HCO3)2与Ba(OH)2溶液反应 | D. | NH4HCO3与Ba(OH)2溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
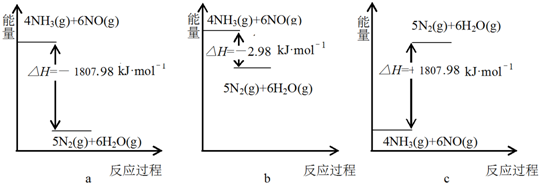
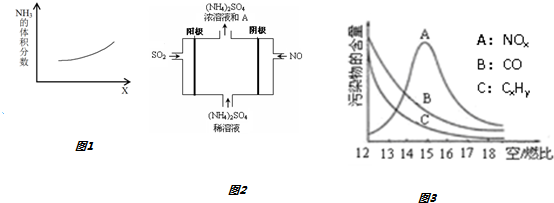
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫可广泛用于食品的漂白 | |
| B. | 从海水提取物质都必须通过化学反应才能实现 | |
| C. | 葡萄糖可用于补钙药物的合成 | |
| D. | “地沟油”禁止食用,也不能用来制肥皂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com