
 锰锌软磁铁氧体具有高磁导率、低矫顽力和低功率损耗等性能,已广泛应用于电子工业.碳酸锰主要用于制备锰锌软磁铁氧体,而制碳酸锰的原料之一是二氧化锰.某化学研究性学习小组拟从废旧干电池中回收二氧化锰制取碳酸锰.
锰锌软磁铁氧体具有高磁导率、低矫顽力和低功率损耗等性能,已广泛应用于电子工业.碳酸锰主要用于制备锰锌软磁铁氧体,而制碳酸锰的原料之一是二氧化锰.某化学研究性学习小组拟从废旧干电池中回收二氧化锰制取碳酸锰.| 实验步骤(不要求写出具体步骤) | 预期的实验现象和结论 |
| 将所得沉淀过滤、洗涤, 将沉淀充分暴露于空气中,观察颜色 | 颜色变成褐色,说明含有Mn(OH)2 |
| 取少量沉淀于试管中,加入足量的盐酸,观察现象 | 没有气泡生成,说明不含MnCO3 |
分析 (1)在第②步中,将含有MnO2的固体与浓盐酸混合加热发生反应:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O可以使MnO2还原转化为Mn2+;
(2)③步中的Na2CO3溶液换成NH4HCO3溶液,也能达到上述目的,但同时有气体生成为二氧化碳气体;
(3)根据题目信息可知:沉淀的成分可能全部为MnCO3,可能全部为Mn(OH)2,还可能是MnCO3和Mn(OH)2;
①根据Mn(OH)2暴露在空气中时间稍长,易被氧化成褐色的MnO(OH)2来分析有无Mn(OH)2;根据MnCO3能与盐酸反应放出气体来分析有无MnCO3;
②固体质量最小值是15.8g是MnO的质量,在300℃以后,通过质量增加量为MnO氧化为MnO2,求出MnO的质量,进而求出含有MnO2的质量;由于Mn(OH)2暴露在空气中时间稍长,易被氧化成褐色的MnO(OH)2,分解得到MnO2,根据MnO2的质量求出Mn(OH)2的质量,从而求出MnCO3质量;
解答 解:(1)在第②步中,将上述固体与浓盐酸混合的目的是利用浓盐酸还原二氧化锰为锰离子;
故答案为:将MnO2还原成Mn2+;
(2)将第③步中的Na2CO3溶液换成NH4HCO3溶液,也能达到上述目的,但同时有气体生成为二氧化碳气体,反应的离子方程式为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O;
故答案为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O;
(3)根据题目信息可知:沉淀的成分可能全部为MnCO3,可能全部为Mn(OH)2,还可能是MnCO3和Mn(OH)2,所以有三种假设:假设一:全部为MnCO3;假设二:全部为Mn(OH)2;假设三:既有MnCO3又有Mn(OH)2;
故答案为:既有MnCO3又有Mn(OH)2;
①将所得沉淀过滤、洗涤将沉淀充分暴露于空气中,观察颜色,颜色变成褐色,说明含有Mn(OH)2;另取少量沉淀于试管中,加入足量的盐酸,观察现象,没有气泡生成,说明不含MnCO3.为此证明固体是Mn(OH)2;
故答案为:
| 实验步骤(不要求写出具体步骤) | 预期的实验现象和结论 |
| 将沉淀充分暴露于空气中,观察颜色 | 颜色变成褐色,说明含有Mn(OH)2 |
| 取少量沉淀于试管中,加入足量的盐酸,观察现象 | 没有气泡生成,说明不含MnCO3 |
点评 本题主要考查物质的制取、成分的检验、氧化还原反应原理、离子方程式的书写的知识,题目综合性较强,注意题目信息的提取与运用,难度较大.


科目:高中化学 来源: 题型:解答题
| 符合的条件 | 序号 | |
| 1 | 混合物 | |
| 2 | 电解质,但熔融状态下并不导电 | |
| 3 | 电解质,但难溶于水 | |
| 4 | 非电解质 | |
| 5 | 既不是电解质,也不是非电解质,但能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol O的质量为16g•mol-1 | |
| B. | 1mol He约含有6.02×1023个原子 | |
| C. | 2H既表示2个氢原子,又表示2mol氢原子 | |
| D. | 1mol HCl约含有6.02×1023个原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
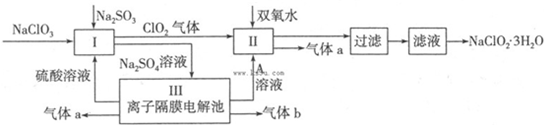
| 弱酸 | HClO2 | HF | H2CO3 | H2S |
| Ka/mol•L-1 | 1×10-2 | 6.3×10-4 | K1=4.30×10-7 K2=5.60×10-11 | K1=9.1×10-8 K2=l.1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
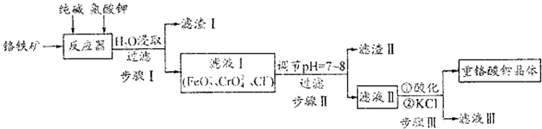
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
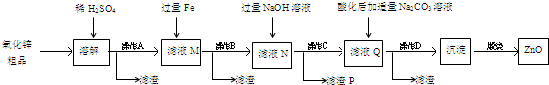
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 mL 2 mol•L-1盐酸 | B. | 150 mL 2 mol•L-1硫酸 | ||
| C. | 500 mL 3 mol•L-1盐酸 | D. | 500 mL 18.4 mol•L-1浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
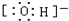 B
B E
E
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下22.4LNO2中分子数约为NA个 | |
| B. | 常温下,18g${\;}_{\;}^{18}$O2中含有个NA氧原子 | |
| C. | 31g白磷中含的共价键数为3NA | |
| D. | 25℃时pH=13的NaOH溶液中含有0.1NAOH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com