
主族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 元 素 | N | S | O | Si |
| 原子半径/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
 ,
, ;
;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、核素就是同位素 |
| B、元素的金属性强弱与元素失去电子数的多少成正比 |
| C、含有离子键的化合物一定是离子化合物 |
| D、含有共价键的化合物一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
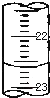 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.50 | 25.40 |
| 第二次 | 20.00 | 4.00 | 29.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用激光笔光束鉴别氯化铁溶液和氢氧化铁胶体 |
| B、用KSCN溶液鉴别Fe3+和Fe2+ |
| C、用氨水鉴别Al3+和Mg2+ |
| D、用焰色反应鉴别碳酸钠溶液和碳酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.12 g |
| B、2.2 g |
| C、3.2g |
| D、6.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:
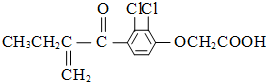
| A、该有机物能发生银镜反应 |
| B、分子中有4个碳碳双键 |
| C、既能发生还原反应,又能发生氧化反应 |
| D、1 mol 该物质最多跟6 mol氢气发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、N2+O2
| |||
| B、2NO+O2→2NO2 | |||
| C、3NO2+H2O→2HNO3+NO | |||
D、4NH3+5O2
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com