
【题目】用下列实验装置(部分夹持装置略去)进行相应的实验,能达到实验目的的是
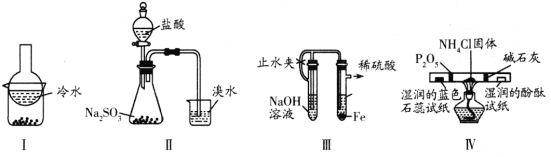
A. 加热装置Ⅰ中的烧杯分离I2和高锰酸钾固体
B. 用装置Ⅱ验证二氧化硫的漂白性
C. 用装置Ⅲ制备氢氧化亚铁沉淀
D. 用装置Ⅳ检验氯化铵受热分解生成的两种气体
【答案】D
【解析】
高锰酸钾固体受热会分解;二氧化硫使品红等有机物褪色是二氧化硫的漂白性;硫酸亚铁溶液与氢氧化钠溶液不能自动混合;氯化铵受热分解生成氨气、氯化氢气体,用酸碱指示剂分别检验。
A项:加热时混合物中的碘升华、碘蒸气遇冷凝华,但高锰酸钾固体会分解,故装置I不能分离I2和高锰酸钾固体,A项错误;
B项:装置Ⅱ中锥形瓶内生成的二氧化硫能使烧杯内溴水褪色,这是二氧化硫的还原性而不是漂白性,B项错误;
C项:装置Ⅲ中,右边试管内生成硫酸亚铁溶液和氢气,氢气排出装置,硫酸亚铁溶液与左边试管内氢氧化钠溶液不能自动混合,不能制备氢氧化亚铁沉淀,C项错误;
D项:装置Ⅳ中,氯化铵受热分解生成氨气、氯化氢的混合气体,P2O5吸收氨气,湿润的蓝色石蕊试纸检验氯化氢。碱石灰吸收氯化氢,湿润的酚酞试纸检验氨气,D项正确。
本题选D。


 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
【题目】如图容器底部是培养基,其中含有植物生长所需的全部养分,如果有人在配制培养基的矿质元素中使用了NH4NO3、KNO3、CaCl2·2H2O、MgSO4·7H2O、螯合铁溶液、微量元素溶液,但缺少了一种必需元素,为补充这种元素,应添加的化合物是( )

A.Ca(NO3)2B.KClC.KH2PO4D.K2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝的利用成为人们研究的热点,是新型电池研发中重要的材料。
(1)通过以下反应制备金属铝。
反应1:Al2O3(s)+AlCl3(g)+3C(s)===3AlCl(g)+3CO(g);ΔH1=akJ·mol-1
反应2:Al2O3(s)+3C(s)===2Al(l)+3CO(g);ΔH2=bkJ·mol-1
反应3:3AlCl(g)===2Al(l)+AlCl3(g);ΔH3
①反应3的ΔH3=_______kJ·mol-1。
②950℃时,铝土矿与足量的焦炭和Cl2反应可制得AlCl3。该反应的化学方程式是_______。
(2)在高温条件下进行反应:2Al(l)+AlCl3(g)![]() 3AlCl(g)。
3AlCl(g)。
①向图1所示的等容积A、B密闭容器中加入足量的Al粉,再分别充入1 mol AlCl3(g),在相同的高温下进行反应。图2表示A容器内的AlCl3(g)体积分数随时间的变化图,在图2中画出B容器内AlCl3(g)体积分数随时间的变化曲线。__________
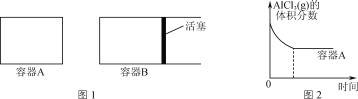
②1100℃时,向2 L密闭容器中通入3 mol AlCl(g),发生反应:3AlCl(g)=2Al(l)+AlCl3(g)。已知该温度下AlCl(g)的平衡转化率为80%,则该反应的平衡常数K=________。
③加入3molAlCl(g),在不同压强下发生反应,温度对产率的影响如图3所示。此反应选择温度为900℃的原因是_______________。
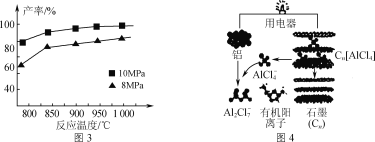
(3)用铝制作的快速放电铝离子二次电池的原理如图4所示。
①该电池充电时,阴极的电极反应式为_____。
②AlCl3和NaCl的熔融盐常用于镀铝电解池,电镀时AlCl4-和Al2Cl7-两种离子在电极上相互转化,其他离子不参与电极反应。NaCl的作用是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)2SO2(g)+O2(g)![]() 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH= 99 kJ/mol。
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH= 99 kJ/mol。

请回答下列问题:
①图中A点表示:__________________________。
C点表示:______________________________。
E的大小对该反应的反应热______(填“有”或“无”)影响。
②25℃、101 kPa下测得,2mol SO2和1 mol O2充分反应放出热量________198 kJ(填“大于”、“等于”或“小于”)。
(2)由氢气和氧气反应生成1 mol水蒸气,放出241.8 kJ热量(25℃、101 kPa下测得)
①写出该反应的热化学方程式:_____________________________。
②若1 mol水蒸气转化为液态水放热45kJ,则反应H2(g)+![]() O2(g)
O2(g)![]() H2O( l )的ΔH =________________kJ/mol。
H2O( l )的ΔH =________________kJ/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是( )

A.洗气瓶中产生的沉淀是碳酸钡
B.洗气瓶中产生的沉淀是硫酸钡
C.在Z导管出来的气体中没有二氧化碳
D.在Z导管口排出无色气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加入等质量的铝,生成氢气的体积比为5:6,则甲、乙两烧杯中的反应情况可能分别是
A. 甲、乙中都是铝过量 B. 甲中铝过量,乙中碱过量
C. 甲中酸过量,乙中铝过量 D. 甲中酸过量,乙中碱过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是产生和收集气体的实验装置,该装置适合于( )

A.用浓硝酸与Cu反应制取NO2B.用浓盐酸和MnO2反应制取Cl2
C.用H2O2溶液和MnO2反应制取O2D.用NH4Cl和Ca (OH)2反应制取NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.56g铜粉加入100mL0.4mol·L-1的稀HNO3溶液中,加热充分反应后再加入100mL0.2mol·L-1的H2SO4溶液,继续加热,待充分反应后,所得溶液中Cu2+的物质的量浓度是(忽略溶液体积变化)( )
A.0.15mol·L-1B.0.2mol·L-1C.0.075mol·L-1D.0.45mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】车辆碰撞瞬间,安全装置通电点火,使其中的粉末分解释放出大量保护气形成安全气囊。经分析确定气囊中粉末含有Na、Al、N、O四种元素,叠氮化钠(NaN3)经碰撞后会分解为Na、N2。
(1)氮原子的最外层电子排布式是______,氧原子核外有______种能量不同的电子,叠氮化钠固体中阴阳离子的个数比为1:1,则该固体中含有的化学键是______(填化学键名称)。
(2)在酸性溶液中,Al的最高价氧化物对应水化物的电离方程式为______。
(3)氮和氧两种元素,非金属性较强的是______,请用一个事实说明其强弱______。
工业上,通过如下转化可制得KClO3晶体:NaCl溶液![]() NaClO3溶液
NaClO3溶液![]() KClO3晶体
KClO3晶体
(4)①配平并完成Ⅰ中反应的总化学方程式,并用单线桥标出电子转移的方向和数目:______NaCl+______H2O![]() ______NaClO3+______
______NaClO3+______
②Ⅱ反应过程能析出KClO3晶体而无其它晶体析出的原因是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com