
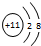 ,F中的化学键为离子键、共价键;
,F中的化学键为离子键、共价键; ; F和AB2反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2;
; F和AB2反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2;分析 A、B、C、D、E 5种元素,已知:A原子最外层电子数是次外层电子数的两倍,则A原子只能有2个电子层,最外层电子数为4,故A为碳元素;E原子M层上的电子比K层多5个,则其M层电子数为7,故E为Cl;常温下B2是气体,它对氢气的相对密度是16,则B2的相对分子质量为32,B的阴离子与氖原子的电子层结构相同,所以B为O元素;C的单质在B2中燃烧,生成淡黄色固体F,F与AB2反应可生成B2,则F为Na2O2,DB2中D的质量分数为50%,则D的相对原子质量=32,D的单质在B2中燃烧,发出淡紫色火焰,生成有刺激性气味的气体DB2,则D为S元素,据此答题.
解答 解:A、B、C、D、E 5种元素,已知:A原子最外层电子数是次外层电子数的两倍,则A原子只能有2个电子层,最外层电子数为4,故A为碳元素;E原子M层上的电子比K层多5个,则其M层电子数为7,故E为Cl;常温下B2是气体,它对氢气的相对密度是16,则B2的相对分子质量为32,B的阴离子与氖原子的电子层结构相同,所以B为O元素;C的单质在B2中燃烧,生成淡黄色固体F,F与AB2反应可生成B2,则F为Na2O2,C为Na,DB2中D的质量分数为50%,则D的相对原子质量=32,D的单质在B2中燃烧,发出淡紫色火焰,生成有刺激性气味的气体DB2,则D为S元素,
(1)E为氯元素,原子序数为17,位于第三周期ⅦA族,
故答案为:三;ⅦA;
(2)C的离子结构示意图为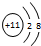 ,则Na2O2中的化学键为离子键、共价键,
,则Na2O2中的化学键为离子键、共价键,
故答案为: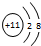 ;离子键、共价键;
;离子键、共价键;
(3)CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,其电子式为 ;F为Na2O2,过氧化钠与二氧化碳反应生成碳酸钠和氧气,反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,
;F为Na2O2,过氧化钠与二氧化碳反应生成碳酸钠和氧气,反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,
故答案为: ;2Na2O2+2CO2=2Na2CO3+O2;
;2Na2O2+2CO2=2Na2CO3+O2;
(4)Na、Cl、S位于同一周期,原子序数越大,非金属性越强,则非金属性:Na<Cl<S,
故答案为:Na<Cl<S;
(5)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,该反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O.
点评 本题考查结构性质位置关系,题目难度中等,推断元素为解答关键,侧重对离子结构示意图、化学方程式等化学用语的考查,注意掌握常见化学用语的规范书写.


科目:高中化学 来源: 题型:选择题
| A. | 在熔融电解质中,O2-由正极移向负极 | |
| B. | 当负极消耗4.48L气体时,转移电子5.2mole- | |
| C. | 电子的流动方向:负极经外电路流向正极,再通过内电路流回负极 | |
| D. | 通入丁烷的一极是负极,电极反应为:C4H10-26e-+13O2-═4CO2+5H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 )和新
)和新 ) ⑤
) ⑤ 和
和 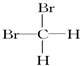 ⑥甲烷和丙烷
⑥甲烷和丙烷查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 研究采煤、采油新技术,提高产量以满足工业生产的快速发展 | |
| B. | 将煤进行气化处理,提高煤的综合利用效率 | |
| C. | 开发太阳能、水能、风能、可燃冰等新能源,减少使用煤、石油等化石燃料 | |
| D. | 实现资源的“3R”利用观,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、资源的循环再生(Recycle) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲 | 乙、丙、丁 | |
| ① | 常见干燥剂 | 浓硫酸、石灰石、碱石灰 |
| ② | 常见合金 | 不锈钢、青铜、生铁 |
| ③ | 腐蚀品 | 浓硫酸、烧碱、硝酸 |
| ④ | 碱性氧化物 | 过氧化钠、氧化镁、氧化铁 |
| ⑤ | 弱电解质 | 醋酸、一水合氨、水 |
| A. | ①② | B. | ③④⑤ | C. | ②③⑤ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
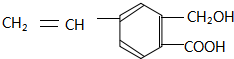 ,关于有机物M的说法正确的是( )
,关于有机物M的说法正确的是( )| A. | 有机物M中含有四种官能团 | |
| B. | 1 molNa2CO3最多能消耗1 mol有机物M | |
| C. | 1 mol M和足量金属钠反应生成22.4 L气体 | |
| D. | 有机物M能发生取代、氧化和加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
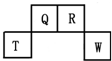 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题: ,R氢化物分子的结构式为
,R氢化物分子的结构式为 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com