
| 温度℃ | 400 | 500 | 830 | 1 000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| A | B | C | D | |
| n(CO2)/mol | 0 | 1 | 3 | 1 |
| n(H2)/mol | 0 | 2 | 2 | 1 |
| n(CO)/mol | 3 | 0.5 | 1 | 2 |
| n(H2O)/mol | 3 | 2 | 5 | 2 |
分析 (1)根据平衡常数随温度的变化表得出,温度越低,平衡常数越大,据此分析;
(2)化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断;
(3)根据830℃时,平衡常数k=1,依据浓度计算和平衡常数比较判断;
(4)依据平衡三段式列式计算反应的一氧化碳,根据转化率=$\frac{转化量}{总量}$×100%,v=$\frac{△c}{△t}$计算得到.
解答 解:(1)由平衡常数随温度的变化表得出,温度越低,平衡常数越大,则降低温度,平衡正向移动,故答案为:正向移动;
(2)A、反应前后气体的体积不变,故容器内混合气体分子总数不再发生变化不能作为判断是否达到化学平衡状态的依据,故A错误;
B、密度=$\frac{总质量}{体积}$,总质量不变,体积不变,故混合气体的密度不再改变不能作为判断是否达到平衡状态的依据,故B错误;
C、K=$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$仅与温度有关,又恒容绝热容器,所以$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$不再变化即温度不变可作为判断是否达到平衡状态的依据,故C正确;
D、单位时间内消耗18g H2O即1mol同时生成1mol CO2,都是指正反应方向,不能作为判断是否达到平衡状态的依据,故D错误;
故选C;
(3)根据830℃时,平衡常数k=1计算;
A、只有反应物,反应向正反应方向移动,故A正确;
B、Q=$\frac{1×2}{0.5×2}$>1,反应向逆反应方向移动,故B错误;
C、Q=$\frac{2×3}{5×1}$>1,反应向逆反应方向移动,故C错误;
D、Q=$\frac{1×1}{2×2}$=$\frac{1}{4}$<1,反应向正反应方向移动,故D正确;
故答案为:AD;
(4)830℃时,在2L的密闭容器中加入4molCO(g)和4molH2O(g)达到平衡时,设一氧化碳转化物质的量为x,依据平衡三段式列式得到
CO(g)+H2O(g)?H2(g)+CO2(g)
起始量(mol) 4 4 0 0
变化量(mol) x x x x
平衡量(mol) 4-x 4-x x x
平衡常数K=$\frac{x{\;}^{2}}{(4-x)(4-x)}$=1,解得x=2mol
CO的转化率=$\frac{2mol}{4mol}$×100%=50%,v(CO)=$\frac{△c}{△t}$=$\frac{\frac{2mol}{2L}}{2min}$=0.5mol/(L•min);
故答案为:50%;0.5mol/(L•min).
点评 本题考查化学平衡状态的判断、移动原理及其平衡常数的分析判断,题目难度不大,要注意把握平衡状态的特征.


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{z}{12m}$ | B. | $\frac{12z}{m}$ | C. | $\frac{{N}_{A}}{m}$ | D. | $\frac{{N}_{A}}{z}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 碱式碳酸铜是一种化工原料,化学式用mCu(OH)2•nCuCO3表示.实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
碱式碳酸铜是一种化工原料,化学式用mCu(OH)2•nCuCO3表示.实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
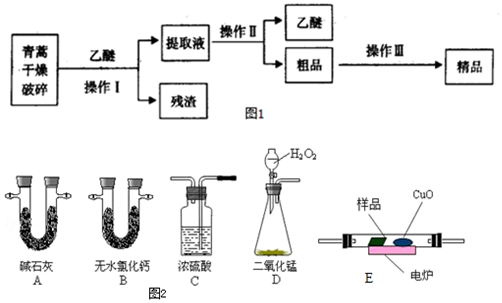
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
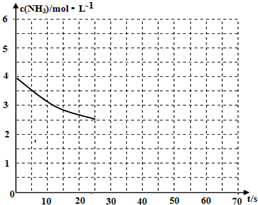 (2)①用氨气制取尿素[CO(NH2)]的反应为:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H<0.
(2)①用氨气制取尿素[CO(NH2)]的反应为:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H<0.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Ba2+、SO42-,Fe3+、K+ | B. | OH-、C1-、Na+ | ||
| C. | NH4+、NO3-、A13+、K+ | D. | HCO3-、SO42-、Na+、H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com