
| A.往H2S溶液中加碱,有利于S2-增多 |
| B.500℃左右比室温更利于氨的合成 |
| C.使用V2O5作催化剂可加快SO2转化为SO3的速率 |
| D.醋酸溶液与锌反应放出H2,加入适量醋酸钠晶体可以减慢放出H2的速率 |
科目:高中化学 来源:不详 题型:填空题
 CO(g)+H2O(g),
CO(g)+H2O(g),| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 3C(g)达到平衡的标志是:
3C(g)达到平衡的标志是:查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 N2O4(g) ΔH(298K)=-52.7kJ·mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
N2O4(g) ΔH(298K)=-52.7kJ·mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 H2(g)+I2(g)△H>0,H2的物质的量随时间的变化如图示,下列说法正确有是
H2(g)+I2(g)△H>0,H2的物质的量随时间的变化如图示,下列说法正确有是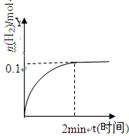
A.该温度下,反应的平衡常数是 |
| B.0~2min内的HI的平均反应速率为0.05mol·L-1·min-1 |
| C.恒压下向该体系中加入N2,平衡不移动,反应速率不变 |
| D.升高温度,平衡向正反应方向移动,只有正反应速率加快 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 3C(g)+2D(g),起始时四个容器所盛A、B的量分别为:甲:2 mol A,1 mol B;乙:1 mol A,1 mol B;丙:2 mol A,2 mol B;丁:1 mol A,2 mol B。在相同温度下建立平衡时,A、B的转化率大小关系正确的是( )
3C(g)+2D(g),起始时四个容器所盛A、B的量分别为:甲:2 mol A,1 mol B;乙:1 mol A,1 mol B;丙:2 mol A,2 mol B;丁:1 mol A,2 mol B。在相同温度下建立平衡时,A、B的转化率大小关系正确的是( )查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g)+D(g),其中a为正整数。反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是
2C(g)+D(g),其中a为正整数。反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是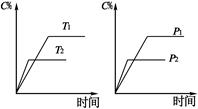
| A.达到平衡后,加入催化剂,则C%增大 |
| B.达到平衡后,若升高温度,平衡向右移动 |
| C.a可以为任意正整数 |
| D.达平衡后,增加A的量,有利于平衡向右移动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.工业制取金属钾:Na(l)+ KCl(l) NaCl(l)+ K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来 NaCl(l)+ K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来 |
| B.冰镇啤酒瓶,把啤酒倒入玻璃杯,杯中立即泛起大量泡沫。 |
| C.在实验室可用排饱和食盐水的方法收集氯气。 |
D.对于2HI(g) H2(g)+I2(g);ΔH>0,缩小容器的体积可使颜色变深。 H2(g)+I2(g);ΔH>0,缩小容器的体积可使颜色变深。 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com