
分析 (1)已知:①N2(g)+2O2(g)=2NO2(g)△H1=+67.7kJ•mol-1;
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H2=-534kJ•mol-1;
⑤H2O(l)=H2O(g)△H3=+44kJ•mol-1.
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l)可以是反应②×2-①-⑤×4得到,由此分析解答;
(2)①N2H4(g)+O2(g)=N2(g)+2H2O(g)△H2=-534kJ/mol;
③H2(g)+F2(g)=2HF(g)△H4=-538kJ/mol
④2H2(g)+O2(g)=2H2O (g)△H2=-484kJ/mol;
依据盖斯定律③×2-④+①得到,由此分析解答.
解答 解:(1)已知:①N2(g)+2O2(g)=2NO2(g)△H1=+67.7kJ•mol-1;
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H2=-534kJ•mol-1;
⑤H2O(l)=H2O(g)△H3=+44kJ•mol-1.
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l)可以是反应②×2-①-⑤×4得到,
所以该反应的焓变=(-534kJ•mol-1)×2-67.7kJ•mol-1-(+44kJ•mol-1)×4=-1311.7kJ/mol,
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l)△H=-1311.7kJ/mol;
(2)①N2H4(g)+O2(g)=N2(g)+2H2O(g)△H2=-534kJ/mol;
③H2(g)+F2(g)=2HF(g)△H4=-538kJ/mol
④2H2(g)+O2(g)=2H2O (g)△H2=-484kJ/mol;
依据盖斯定律③×2-④+①得到热化学方程式为:N2H4(g)+2F2(g)=N2(g)+4HF(g)△H=-1126KJ/mol;
故答案为:N2H4(g)+2F2(g)=N2(g)+4HF(g)△H=-1126KJ/mol.
点评 本题考查了热化学方程式的书写方法和盖斯定律的计算应用,题目较简单.


科目:高中化学 来源: 题型:解答题
 W、X、Y、Z四种短周期元素在周期表中的位置如图1所示,其中Y与钠元素和氢元素均可形成原子个数1:1和1:2的化合物.
W、X、Y、Z四种短周期元素在周期表中的位置如图1所示,其中Y与钠元素和氢元素均可形成原子个数1:1和1:2的化合物.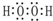 ,Z在周期表中的位置第三周期ⅦA族.
,Z在周期表中的位置第三周期ⅦA族.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A>B | B. | A=10-4B | C. | B=10-4A | D. | A=B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl 溶液 | B. | NaBr 溶液 | C. | NaI 溶液 | D. | Na2S 溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
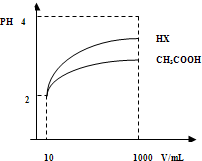 回答下列问题:
回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | b>2a | B. | a=2b | C. | b=2a | D. | b<2a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制取O2;实验室制取H2 | B. | 实验室制取CO2;CO2通入石灰水中 | ||
| C. | 实验室电解水;CaO溶于水 | D. | 氢、氧混合气体爆鸣;蜡烛燃烧 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com