
【题目】I.草酸与高锰酸钾在酸性条件下能够发生如反应:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,用 4mL 0.001mol/L KMnO4 溶液与2mL 0.01mol/L H2C2O4 溶液,研究不同条件对化学反应速率的影响.改变的条件如下:
组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
Ⅰ | 2mL | 20 | |
Ⅱ | 2mL | 20 | 10 滴饱和 MnSO4 溶液 |
Ⅲ | 2mL | 30 | |
Ⅳ | 1mL | 20 | 1mL 蒸馏水 |
(1)该反应中氧化剂和还原剂的物质的量之比为_____
(2)如果研究催化剂对化学反应速率的影响,使用实验_________和_____(用Ⅰ~Ⅳ表示,下同); 如果研究温度对化学反应速率的影响,使用实验_____和_________.
(3)对比实验Ⅰ和Ⅳ,可以研究_____对化学反应速率的影响,实验Ⅳ中加入 1mL蒸馏水的目的是_______
II、利用如图装置采用适当试剂可完成某探究实验,并得出相应实验结论.请根据相关信息回答:

(1)为了证明元素的非金属性强弱是 S>C>Si.你认为各物质应该是: 甲为______;乙为______;丙为______.(已知乙中有气泡产生,丙中 有白色沉淀)
(2)如果甲为水,乙为 Na2O2 粉末,丙为 H2S 的饱和水溶液.实验中观察到丙中生成淡黄色沉淀。说明元素O、S得电子能力强弱为 ______。
(3)将该装置连接好后,在加入药品开始实验前还需进行气密性检查,请你简述该操作_____。
【答案】2∶5 Ⅰ Ⅱ Ⅰ Ⅲ 浓度 使硫酸的浓度不同,但草酸与高锰酸钾的浓度相同 硫酸 碳酸钠 硅酸钠 O>S 用止水夹夹紧连接乙丙装置的乳胶管,向分液漏斗中加入适量水,断开分液漏斗下端活塞,片刻后分液漏斗中液面不再下降,且液面保持不变,说明装置气密性良好
【解析】
Ⅰ.(1)根据化合价的变化分析解答;
(2)研究催化剂对化学反应速率的影响,应保证温度、浓度相同;研究温度对化学反应速率的影响,应保证浓度等其他条件相同;
(3)实验Ⅰ和Ⅳ,硫酸的物质的量不同,研究浓度对反应速率的影响,需要保证其他条件完全相同,只有硫酸浓度不同,据此分析解答;
II.(1)通过复分解反应可以比较物质酸性强弱,最高价氧化物酸性越强,元素非金属性越强,结合实验现象分析判断;
(2)单质的氧化性越强,元素的非金属性越强;
(3)根据装置的特点和气密性检查的一般方法分析解答。
Ⅰ.(1)2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O中,Mn元素的化合价降低,C元素的化合价升高,MnO4-为氧化剂,H2C2O4为还原剂,氧化剂和还原剂的物质的量之比为2∶5,故答案为:2∶5;
(2)研究催化剂对化学反应速率的影响,应保证温度、浓度等条件相同,则选实验Ⅰ、Ⅱ;研究温度对化学反应速率的影响,应保证浓度等条件相同,则选实验Ⅰ、Ⅲ,故答案为:Ⅰ;Ⅱ;Ⅰ;Ⅲ;
(3)实验Ⅰ和Ⅳ,硫酸的浓度不同,可研究浓度对反应速率的影响,加1mL蒸馏水可以使两实验中总体积相等,即使Ⅰ和Ⅳ中硫酸浓度不同,故答案为:浓度;使硫酸的浓度不同,但草酸与高锰酸钾的浓度相同;
II、(1)元素非金属性越强,其最高价氧化物对应的水合物的酸性越强,即酸性硫酸>碳酸>硅酸,根据强酸可以制取弱酸的原理知甲、乙、丙分别为硫酸、碳酸钠、硅酸钠,故答案为:硫酸;碳酸钠;硅酸钠;
(2)水能够与过氧化钠反应生成氧气,氧气的氧化性比硫强,氧气通入硫化氢溶液中可将硫置换出来,则元素O、S得电子能力:O>S,故答案为:O>S;
(3)将该装置连接好后,在加入药品开始实验前还需进行气密性检查,具体操作为:用止水夹夹紧连接乙丙装置的乳胶管,向分液漏斗中加入适量水,断开分液漏斗下端活塞,片刻后分液漏斗中液面不再下降,且液面保持不变,说明装置气密性良好,故答案为:用止水夹夹紧连接乙丙装置的乳胶管,向分液漏斗中加入适量水,断开分液漏斗下端活塞,片刻后分液漏斗中液面不再下降,且液面保持不变,说明装置气密性良好。


科目:高中化学 来源: 题型:
【题目】A、D、E、W是中学常见的四种元素,原子序数依次增大,A的原子最外层电子数是次外层的2倍,D的氧化物属于两性氧化物,D、E位于同周期,A、D、E的原子最外层电子数之和为14,W是人体必需的微量元素,缺乏W会导致贫血症状。
(1)E在元素周期表中的位置是____________。A与E组成的化合物是常用的溶剂,写出其电子式__________________
(2)下列事实能用元素周期表相应规律解释的是(填字母序号)____________。
a.D的最高价氧化物对应水化物的碱性弱于Mg(OH)2
b.E的气态氢化物的稳定性小于HF
c.A的单质能与二氧化硅高温下制得粗品硅单质
(3)WE3的溶液可用于刻蚀铜制的印刷电路板,反应的离子方程式为______。
(4)W的单质可用于处理酸性废水中的NO3-,使其转换为NH4+,同时生成有磁性的W的氧化物X,再进行后续处理,上述反应的离子方程式为______________。上述W的氧化物X能与D的单质反应,写出该反应的化学方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g)= 2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
(2)C(s)+O2(g)= CO2(g) ΔH2=-393.5 kJ/mol
(3)H2(g)+![]() O2(g)= H2O(l) ΔH3=-285.8 kJ/mol
O2(g)= H2O(l) ΔH3=-285.8 kJ/mol
则反应2C(s)+2H2(g)+O2(g)= CH3COOH(l)的焓变为( ).
A.-488.3 kJ/molB.-244.15 kJ/molC.488.3 kJ/molD.244.15 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为镍锌可充电电池放电时电极发生物质转化的示意图,电池使用KOH和K2Zn(OH)4为电解质溶液,下列关于该电池说法正确的是
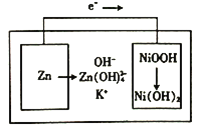
A. 放电时溶液中的K+移向负极
B. 充电时阴极附近的pH会升高
C. 放电时正极反应为H++NiOOH+e-=Ni(OH)2
D. 负极质量每减少6.5g,溶液质量增加6.3g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)金刚烷的结构如图1所示,它可看作是由四个等同的六元环组成的空间构型。
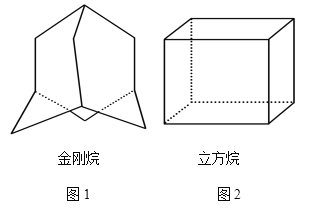
①金刚烷的分子式为________;
②根据中学学过的同分异构体判断规则,判断由溴原子取代分子中的氢原子形成的一溴代物有_____种。
(2)“立方烷”是一种新合成的烃,其分子为正方体结构,其碳架结构如图2所示。
①立方烷的分子式为______________________;
②该立方烷的二氯代物具有同分异构体的数目是_____________;
③将a g立方烷溶于b mL苯中,然后通入c L乙炔(标准状况下),所得混合物中碳的百分含量为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、根据如图回答下列问题。
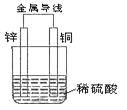
(1)该原电池外电路中电流方向:锌_______铜(填“→”或“←”)。
(2)该原电池中_______电极(写出电极材料名称)产生无色气泡, 写出该电极反应式:_______;该电极发生 _______反应(填“氧化”或“还原”)。 当电路中通过 0.2mol 电子时,该电极上产生的气体在标准状况下的体积为_____L。
(3)一段时间后,烧杯中溶液的 pH______(填“增大”或“减小”)。
II、美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的电池,其构造如图所示:两个 电极均由多孔碳制成,通入的气体由孔隙中流出,并从电极表面放出。
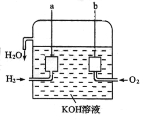
(1)a 极是_____,电极反应式是_____。
(2)b 极是_____,电极反应式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)在不同条件下分解产物不同,200 ℃时在Cu表面分解的机理如图甲所示。已知200 ℃时:
反应Ⅰ:3N2H4(g)===N2(g)+4NH3(g) ΔH1=-32.9 kJ·mol-1
反应Ⅱ:N2H4(g)+H2(g)===2NH3(g) ΔH2=-41.8 kJ·mol-1
下列说法中不正确的是 ( )
A.图所示过程①、②都是放热反应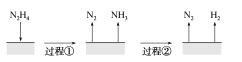
B.反应Ⅱ的能量过程示意图如图所示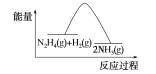
C.断裂3 mol N2H4(g)中的化学键吸收的能量小于形成1 mol N2(g)和4 mol NH3(g)中的化学键释放的能量
D.200 ℃时,肼分解生成氮气和氢气的热化学方程式为N2H4(g)===N2(g)+2H2(g) ΔH=+50.7 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中加入0.15 mol·L-1 A、0.05 mol·L-1 C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图中甲图所示[t0~t1时c(B)未画出,t1时c(B)增大到0.05 mol·L-1]。乙图为t2时刻后改变反应条件,平衡体系中正、逆反应速率随时间变化的情况。
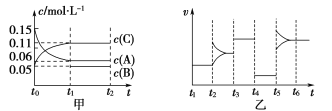
(1)若t4时改变的条件为减小压强,则B的起始物质的量浓度为___mol·L-1。
(2)若t5时改变的条件是升温,此时v(正)>v(逆),若A的物质的量减少0.03 mol时,容器与外界的热交换总量为a kJ,写出反应的热化学方程式:___________________________________。
(3)t3时改变的某一反应条件可能是________(填字母)。
a.使用催化剂 b.增大压强 c.增大反应物浓度
(4)在恒温恒压下通入惰性气体,v(正)________v(逆)(填“>”“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中的有机物种类丰富,在衣食住行等多方面应用广泛,其中乙醇是比较常见的有机物。
(1)乙醇是无色有特殊香味的液体,密度比水_______。
(2)工业上用乙烯与水反应可制得乙醇,该反应的化学方程式为__________________(不写反应条件),原子利用率是______________。
(3)属于乙醇的同分异构体的是_______(选填编号)。
A.![]() B.
B.![]() C.甲醇 D.CH3—O—CH3 E.HO—CH2CH2—OH
C.甲醇 D.CH3—O—CH3 E.HO—CH2CH2—OH
(4)乙醇能够发生氧化反应:
① 46 g乙醇完全燃烧消耗_______mol氧气。
② 乙醇在铜作催化剂的条件下可被氧气氧化为乙醛,反应的化学方程式为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com