
为纪念编制了第一个元素周期表的俄国化学家门捷列夫,人们把第101号元素(人工合成元素)命名为钔。下列关于了258Md和260Md的叙述正确的是
A.258Md原子所含中子数与质子数之差为56
B.258Md和260Md互称为同素异形体
C.258Md和260Md为同一种核素
D.有一种Md元素的相对原子质量为258
科目:高中化学 来源: 题型:
下列各物质,能由单质间发生化合反 应得到,但不能由单质与酸发生置换反应得到的是 ( )。
应得到,但不能由单质与酸发生置换反应得到的是 ( )。
A.MgCl2 B.FeCl2 C.AlCl3 D.CuCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
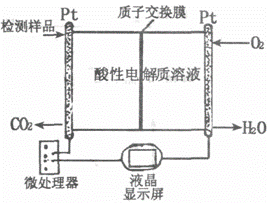
研究CO、SO2、NO等大气污染气体的综合处理与利用具有重要意义。
(1)以CO或CO2与H2为原料,在一定条件下均可合成甲醇,你认为用哪种合成设计线路更符合“绿色化学”理念:(用化学反应方程式表示) 。
(2)右图所示是用于合成甲醇产品中甲醇含量的检测仪。写出该仪器工作时的电极反应式:
负极 ,正极 。
(3)一定条件下,NO2和SO2反应生成SO3(g)和NO两种气体,现将体积比为1:2的NO2和SO2的混合气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。(填序号)
A.体系压强保持不变 B.混合气体颜色保持不变
C.SO3、NO的体积比保持不变 D.每消耗 1 mol SO2,同时生成1 mol NO
当测得上述平衡体系中NO2与SO2体积比为1:6时,则该反应平衡常数K值为 ;
(4)工业常用Na2CO3饱和溶液回收NO、NO2气体:
NO+NO2+Na2CO3===2NaNO2+CO2 2NO2+Na2CO3===NaNO3+NaNO2+CO2
若用足量的Na2CO3溶液完全吸收NO、NO2混合气体,每产生标准状况下CO2 2.24L(CO2气体全部逸出)时,吸收液质量就增加4.4g,则混合气体中NO和NO2体积比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
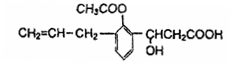
有机物的结构简式如下图:则此有机物可发生的反应类型有
①取代 ②加成 ③消去 ④酯化 ⑤水解 ⑥氧化 ⑦中和
A.①②③⑤⑥
B.②③④⑤⑥
C.①②③④⑤⑥⑦
D.②③④⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
由环己烷、乙醇、乙醚组成的混合物,经测定碳的质量分数为72%,则氧的质量分数为。
A.19.6 % B.17.8 % C.16 % D.14.2 %
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
①元素原子的最外层电子数等于元素的最高化合价
②最外层一个电子的元素一定是金属元素,肯定在元素周期表的第IA族
③所有元素的原子最外层最多可容纳的电子数均为8
④第三周期元素随原子序数增大各非金属元素对应的氧化物的水化物酸性一定逐渐增强
⑤同主族元素随原子序数增大,其原子半径逐渐增大
A. ①②③④⑤ B. ①②③ C. ④⑤ D. ⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组化合物中,化学键类型有关叙述正确的是( )
A.CaCl2和Na2O2中都只含有离子键
B.NaOH和NaHS都既含有离子键,又含有极性键
C.CO2和H2S中都只含有非极性键
D.H2O2和CS2都既含有极性键,又含有非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
对于常温下pH为1的H2SO4溶液,下列叙述正确的是 ( )
A.该溶液1 mL稀释至100 mL后,pH等于2
B.向该溶液中加入等体积、pH为13的NaOH溶液恰好完全中和
C.该溶液中H2SO4电离出的c(H+)与水电离出的c(H+)之比为10-12
D.1L该溶液中含有H2SO4分子的物质的量为0.05moL
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)合成氨工业对国民经济和社会发展具有重要的 意义。某合成氨工业中氢气由天然气和水反应制备,其主要反应为:
CH4 (g)+ 2H2O (g) 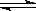 CO2(g)+4H2 (g)
CO2(g)+4H2 (g)
反应过程中能量变化如图所示,则该反应为__________反应(填“吸热”或“放热”)
(2)某温度下,10L密闭容器中充入2mol CH4和 3molH2O(g),发生CH4 (g)+ 2H2O (g) 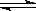 CO2(g)+4H2 (g)反应,反应进行到4s时CO2 的物质的量浓度为0.08mol/L,再过一段时间反应达平衡,平衡时容器的压强是起始时的1.4倍。则:
CO2(g)+4H2 (g)反应,反应进行到4s时CO2 的物质的量浓度为0.08mol/L,再过一段时间反应达平衡,平衡时容器的压强是起始时的1.4倍。则:
①前4s以CH4浓度变化表示的平均反应速率为多少?
② 4s时,混合气体中H2的体积分数为多少?
 ③平衡时,H2O (g)的浓度是多少?(要求:写出计算过程)
③平衡时,H2O (g)的浓度是多少?(要求:写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com