
【题目】四种短周期元素在周期表中的相对位置如图所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。请回答下列问题:
X | Y | |
Z | W |
(1)元素Z位于周期表中第____周期____族。
(2)X、Y元素氢化物稳定性强弱顺序是____(用化学式表示)。
(3)Y、Z的最高价氧化物对应水化物的酸性强弱顺序是____(用化学式表示)。
(4)原子序数比Y多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是____ 。
【答案】三 ⅤA NH3>CH4 HNO3>H3PO4 2H2O2![]() 2H2O+O2↑(或其他合理答案)
2H2O+O2↑(或其他合理答案)
【解析】
根据四种短周期元素在周期表中的相对位置关系图,X、Y为第二周期元素,Z、W为第三周期元素。短周期元素,Z元素原子的核外电子总数是其最外层电子数的3倍,设最外层为x,则(2+8+x)=3x,解得x=5,则Z为P,则X为C,Y为N,W为S,据此分析解答。
根据上述分析,Z为P,X为C,Y为N,W为S。
(1)Z为P,原子结构中有3个电子层,最外层电子数为5,则位于元素周期表中的第三周期,第VA族,故答案为:三;VA;
(2)同一周期从左向右,非金属性增强,对应氢化物的稳定性增强,非金属性C<N,则氢化物稳定性强弱顺序是NH3>CH4,故答案为:NH3>CH4;
(3) 同一周期从左向右,非金属性增强,则最高价含氧酸的酸性增强,非金属性N>P,最高价氧化物对应水化物的酸性强弱顺序是HNO3>H3PO4,故答案为:HNO3>H3PO4;
(4)原子序数比Y多1的元素是O,O元素一种氢化物能分解为它的另一种氢化物,为过氧化氢的分解,反应的化学方程式为2H2O2![]() 2H2O+O2↑,故答案为:2H2O2
2H2O+O2↑,故答案为:2H2O2![]() 2H2O+O2↑。
2H2O+O2↑。


科目:高中化学 来源: 题型:
【题目】A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:

(1)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。写出②反应的离子方程式_______________________________________;④反应离子方程式__________________________________________________。
(2)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种黄绿色气体单质。写出A与水高温下反应的化学方程式_________________________________。④反应的离子方程式_________________________。D中加入氢氧化钠的现象_____________________。
(3)若A是太阳能电池用的光伏材料,B常用于制作高档光学器材,C、D为钠盐,C的水溶液俗称水玻璃,D的溶液显碱性。④反应也是通入一种引起温室效应的主要气体。写出③反应的化学方程式___________________________________。⑤反应用到B,反应条件为高温,则⑤的化学方程式为___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙实验小组设计如下实验装置分别制备SnCl4和漂白粉。


(1)已知:a.金属锡熔点231 ℃,化学活泼性与铁相似;
b.干燥的氯气与熔融金属锡反应生成SnCl4,SnCl4的沸点114 ℃;
c.SnCl2、SnCl4均易水解,易溶于有机溶剂,且Sn2+易被氧化。根据图甲装置回答:
①试管Ⅱ中的试剂是____________________,Ⅲ中的试剂是________________________。
②Ⅵ处装置最好选用________(填字母)。
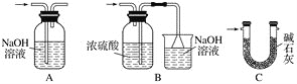
③Ⅰ处装置中反应的离子方程式是____________________________________________。
④实验结束后,欲回收利用装置Ⅰ中未反应完的MnO2,需要的玻璃仪器有______________。
(2)已知:①Cl2与潮湿的消石灰反应是放热反应;②温度较高时Cl2与潮湿Ca(OH)2的反应为6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O。
根据图乙装置回答:此实验所得Ca(ClO)2产率较低的理由是
①________________________________________________________________________;
②________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】深埋在潮湿土壤中的铁管道,在硫酸盐还原菌作用下,能被硫酸根离子腐蚀,其电化学腐蚀原理如图所示,下列与此原理有关的说法中错误的是( )
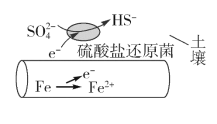
A.这种情况下,Fe腐蚀的最终产物为Fe2O3·xH2O
B.输送暖气的管道不易发生此类腐蚀
C.SO42-在正极得电子,发生还原反应
D.管道上刷富锌油漆可以延缓管道的腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年6月6日,工信部正式向四大运营商颁发了5G商用牌照,揭示了我国5G元年的起点。通信用磷酸铁锂电池其有体积小、重量轻、高温性能突出、可高倍率充放电、绿色环保等众多优点。磷酸铁锂电池是以磷酸铁锂为正极材料的一种锂离子二次电池,放电时,正极反应式为M1-xFexPO4+e-+Li+=LiM1-x FexPO4,其原理如图所示,下列说法正确的是( )
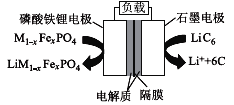
A.放电时,电流由石墨电极流向磷酸铁锂电极
B.电池总反应为M1-xFexPO4+LiC6![]() Li M1-xFexPO4+6C
Li M1-xFexPO4+6C
C.放电时,负极反应式为LiC6-e-=Li++6C
D.充电时,Li+移向磷酸铁锂电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下面的原子或离子结构示意图的编号(A、B、C、D)填空:
![]()
(1)电子层排布相同的是______________;
(2)属于同种元素的是________________;
(3)属于金属元素的是 ___________________;
(4)属于稀有气体元素的是______________,稀有气体一般不参加化学反应的原因是_______
(5)写出D参加化学反应后所得离子的结构示意图 _____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在焊接铜器时可用NH4Cl溶液除去铜器表面的氧化铜以便焊接,其反应为:CuO+NH4Cl → Cu+CuCl2+N2↑+H2O(未配平)。下列说法正确的是
A. 反应中被氧化和被还原的元素分别为Cu和N
B. 反应中氧化剂和还原剂的物质的量之比为3∶2
C. 反应中产生0.2 mol气体时,转移0.6 mol电子
D. 该反应中被还原的CuO占参与反应CuO的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用来减轻感冒症状的布洛芬的结构简式如图所示,下列有关说法不正确的是( )
![]()
A.1mol布洛芬能与足量NaHCO3溶液反应最多生成1molCO2
B.布洛芬的分子式为C13H18O2
C.布洛芬苯环上的一溴代物有2种
D.布洛芬与苯甲酸甲酯是同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌是人体必需的微量元素,在体内有着重要的功能,然而过度的Zn2+会引起毒性,因此能够高效、灵敏检测Zn2+的方法非常重要。化合物L对Zn2+有高识别能力和良好的抗干扰性,其合成路线可设计如下:
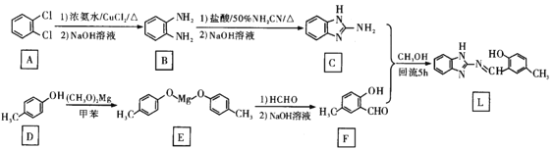
回答下列问题:
(1)A的化学名称为____________F的官能团名称为____________。
(2)D生成E的化学方程式为________________,该反应类型为____________。
(3)已知R-N=N-R分子中的N原子存在孤对电子(未共用电子对),且N = N双键不能旋转,因而存在顺反异构:![]() (顺式),
(顺式),![]() (反式)。判断化合物L是否存在顺反异构________(填“是”或“否”)。
(反式)。判断化合物L是否存在顺反异构________(填“是”或“否”)。
(4)研究人员利用某种仪器进行分析,发现化合物L中亚氨基(-NH-)及-OH上的氢原子的.吸收峰在结合Zn2+后的谱图中消失,该仪器的名称是___________仪;研究人员推测化合物L结合Zn2+的机理为:![]() 其中,Zn2+与-N=之间共价键的成键方式是________(填标号)。
其中,Zn2+与-N=之间共价键的成键方式是________(填标号)。
a. Zn2+和N原子各自提供单电子组成共用电子对
b. Zn2+单方面提供电子对与N原子共用
c. N原子单方面提供电子对与Zn2+共用
(5)X为F的芳香族同分异构体,写出满足如下条件的X的结构简式_____________。
①能发生水解反应和银镜反应,产物之一能与FeCl3溶液发生显色反应;
②有六种不同化学环境的氢,个数比为3:1:1:1:1:1。
(6)已知:通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。化合物Y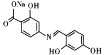 具有抑菌活性,以
具有抑菌活性,以![]() 和
和![]() 为原料制备Y,写出合成路线(有机溶剂和无机试剂任选)。____________。
为原料制备Y,写出合成路线(有机溶剂和无机试剂任选)。____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com